Derde molaar (2020)
Nazorg
Inleiding
+Het verwijderen van derde molaren kan in de postoperatieve periode zorgen voor pijn, zwelling en trismus. Dit zijn voor de patiënt onprettige effecten van het verwijderen van een derde molaar die tot gevolg kunnen hebben dat patiënten meer moeite met kauwen of spreken hebben, dat mondhygiëne moeilijker is, en dat patiënten hun dagelijks leven moeten aanpassen wat kan resulteren in absentie op het werk of school. De genezing kan gepaard gaan met complicaties, dat kan resulteren in een alveolitis of wondinfectie. Alveolitis is een van de meest voorkomende postoperatieve complicaties na verwijdering van geïmpacteerde derde molaren in de onderkaak (Rodrıguez Sanchez et al., 2017). Er bestaat een grote variatie in gebruikte definities van alveolitis in de literatuur. Alveolitis komt aanzienlijk meer voor bij verwijdering van een derde molaar dan bij andere gebitselementen (Bloomer, 2000). De pathogenese is onduidelijk. Waarschijnlijk spelen bacteriën een belangrijke rol in het uiteenvallen van het fibrinestolsel (Birn, 1970). Door de pijnklachten kan een patiënt met alveolitis meermalen voor consult komen na een chirurgische verwijdering van een derde molaar. Dit leidt tot aanzienlijk meer behandeltijd van de zorgverlener waar geen vergoeding tegenover staat.
Definitie alveolitis
Een algemene definitie, zoals voorgesteld door Blum (2002), is: postoperatieve pijn in en rond de plaats van verwijdering van een gebitselement die in hevigheid toeneemt tot 1-3 dagen na verwijdering in combinatie met volledige of gedeeltelijke afwezigheid van het bloedstolsel in de alveole, al dan niet gepaard gaand met halitose. Daarnaast kan een onderscheid worden gemaakt in een alveolitis met matige en ernstige symptomen, waarbij de patiënt met ernstige symptomen zeer heftige pijnklachten ervaart, waarbij sprake is van een volledige afwezigheid van het bloedstolsel (dry socket). Adequate nazorg kan het risico op postoperatieve complicaties verminderen. In dit kader wordt aandacht besteed aan het toedienen van antibiotica, gebruik van chloorhexidine en postoperatief spoelen van de alveole met een monoject spuit.
Uitgangsvraag 5.1 - Nazorg
-Dienen antibiotica te worden toegepast?
Inleiding bij uitgangsvraag 5.1
+Het gebruik van antibioticaprofylaxe die het risico op de hiervoor genoemde complicaties mogelijk beperken is controversieel. Dit is deels terug te voeren op de afweging van de grootte van het effect enerzijds en het optreden van bijwerkingen en de (maatschappelijke) noodzaak om resistentie en de kans op het ontwikkelen van allergie voor antibiotica te voorkomen anderzijds.
Aanbevelingen bij uitgangsvraag 5.1
+Geef niet routinematig antibiotica wanneer een derde molaar moet worden verwijderd. Bij aanwezigheid van risicofactoren voor postoperatieve complicaties of in geval van noodzaak tot antibioticaprofylaxe kan hiervan worden afgeweken.
Uitgangsvraag 5.2
-Dient chloorhexidine te worden toegepast?
Inleiding bij uitgangsvraag 5.2
+De vraag is of chloorhexidine als gel of als spoelmiddel het risico op alveolitis vermindert, en in hoeverre de concentratie van chloorhexidine en toedieningsduur op een mogelijk effect van in-vloed zijn.
Aanbevelingen bij uitgangsvraag 5.2
+Overweeg het preoperatief laten spoelen met 0,12% of 0,2% chloorhexidine om het risico op alveolitis na verwijdering van een derde molaar te verminderen.
Aangezien het merendeel van de patiënten vanwege zwelling in de mond of anderszins slechts een deel van de mond dagelijks kan reinigen:
Overweeg het voorschrijven van 0,12% of 0,2% chloorhexidine om gedurende 7 dagen, te beginnen daags na verwijdering van de derde molaar, tweemaal dagelijks te laten spoelen.
Uitgangsvraag 5.3
-Dient postoperatief spoelen van de alveole m.b.v. een monoject spuit te worden toegepast?
Inleiding bij uitgangsvraag 5.3
+In de vorige paragrafen zijn het preventief gebruik van chloorhexidine en antibiotica in het voor-komen van postoperatieve complicaties na verwijdering van derde molaren besproken. Een grote hoeveelheid debris in de alveole blijkt geassocieerd te zijn met een verhoogd risico op alveolitis na verwijdering van derde molaren in de onderkaak. In de praktijk wordt soms een spuitje meegegeven om de alveole en wond uit te spoelen met water met het doel om de wond schoon te spoelen en daarmee het risico op het optreden van een alveolitis te reduceren. Anderzijds zou het vroegtijdig schoonspuiten van de alveole het bloedstolsel kunnen wegspoelen wat het risico op alveolitis juist zou kunnen verhogen. Hoe sterk is het bewijs dat irrigeren met water het risico op complicaties vermindert?
Aanbevelingen bij uitgangsvraag 5.3
+Er wordt geen aanbeveling gegeven voor het gebruik van irrigatiespuit en kraanwater.
Overwegingen bij uitgangsvraag 5.1
+Kwaliteit van bewijs
Als alveolitis en wondinfecties cruciale uitkomstaten zijn en de overige uitkomstmaten belangrijk maar niet cruciaal voor de strekking van een aanbeveling, dan is de algehele kwaliteit van bewijs laag voor preoperatief, postoperatief en pre- en postoperatief toedienen van antibiotica in verband met het verwijderen van een derde molaar. De cruciale uitkomst met de laagste kwaliteit van bewijs bepaalt de algehele kwaliteit van bewijs.
Waarden en voorkeuren
Volgens de werkgroep is er waarschijnlijk variatie in hoe patiënten bijwerkingen als diarree, maagpijn, braken afwegen tegen het mogelijk voorkómen van wondinfectie en alveolitis.
Kosten
Deze hebben geen invloed op de strekking van de aanbeveling en worden buiten beschouwing gelaten.
Balans van gunstige en ongunstige effecten
Gunstige effecten
| Wondinfectie | Kwaliteit van bewijs | Alveolitis | Kwaliteit van bewijs | |
| Preoperatief | 112 minder per 1.000 (136 tot 54 minder) met amoxicilline | laag | 67 minder per 1.000 (94 tot 1 minder) |
redelijk |
| Postoperatief | 106 minder per 1.000 (116 tot 85 minder) | laag | 7 minder per 1.000 (8 minder tot 22 meer) |
redelijk |
| Pre- en postoperatief | 5 meer per 1.000 (31 minder tot 99 meer) |
laag | 120 minder per 1.000 (183 tot 5 minder) |
redelijk |
Ongunstige effecten
| Bijwerkingen | Kwaliteit van bewijs | |
| Preoperatief | 12 minder per 1.000 (22 minder tot 134 meer) |
laag |
| Postoperatief | 45 meer per 1.000 (7 tot 152 meer) |
laag |
| Pre- en postoperatief | 113 meer per 1.000 (5 minder tot 320 meer) |
laag |
Wat is de balans?
Vanwege het ontbreken van een redelijke tot hoge kwaliteit van bewijs, van een groot en precies effect, en een geringe kans op infectie en alveolitis (ca. 10%) enerzijds en het tegengaan van resistentie en de kans op ontwikkelen allergie en bijwerkingen meent de werkgroep dat het advies moet zijn om geen antibiotica toe te passen.
Aanvaardbaarheid en haalbaarheid
Volgens de werkgroep zijn de aanbevelingen voor de relevante stakeholders acceptabel en haalbaar.
Rationale
De werkgroep heeft veel gewicht toegekend aan de nadelen van het gebruik van antibiotica (ontwikkeling resistentie en allergie, bijwerkingen) en relatief weinig aan de mogelijke voordelen (minder kans op infectie en alveolitis).
Overwegingen bij uitgangsvraag 5.2
+Kwaliteit van bewijs
De kwaliteit van bewijs varieert van laag tot redelijk.
Waarden en voorkeuren
Volgens de werkgroep worden alveolitis aan de ene kant en smaakverandering, nare smaak en verkleuring van gebitselementen aan de andere kant door goed geïnformeerde patiënten cruciale uitkomstmaten gevonden, terwijl, extra tandsteenvorming, en opzwelling van de parotis speekselklier (komt zeer zelden voor) minder belangrijke uitkomstmaten zijn.
Balans van gewenste en ongewenste effecten
- Number needed to treat voor chloorhexidine als mondspoeling (0,12-0,2%; 7 dagen of een halve minuut preoperatief én 7 dagen postoperatief spoelen) en voor chloorhexidine als gel (0,2%; intra-alveolair) is vergelijkbaar: om één extra geval van alveolitis (ten opzichte van placebo) te vóórkomen moeten acht patiënten worden behandeld.
- Een ongewenst effect van chloorhexidine is opzwelling van de parotis speekselklier. Enkele case reports (Van der Weijden et al., 2010) wekken de suggestie dat niet chloorhexidine maar het spoelen zelf de oorzaak is van het opzwellen van de parotis speekselklier.
- Intra-alveolaire applicatie van chloorhexidine heeft geen neveneffecten in termen van verkleuring van gebitselementen, veranderde of nare smaak.
Vrijwel alle besproken studies hebben betrekking op verwijdering van de derde molaar in de onderkaak. Enkele studies betrokken ook derde molaren in de bovenkaak. Het is echter onduidelijk in hoeverre de resultaten van de besproken studies toepasbaar zijn op verwijdering van derde molaren in de bovenkaak. In drie studies waarin chloorhexidine als spoelmiddel werd geëvalueerd, werd in één studie 48 uur na verwijdering van de derde molaar gestart met het spoelen met chloorhexidine: “Postoperative instructions were identical for each group and included avoiding all commercial mouthwashes for 48 hours postoperatively”. In twee studies werd daags na de extractie gestart met spoelen met chloorhexidine: “The day after surgery, the patients began home use of the CHX solution (15 mL for 30 seconds) twice daily for 7 Days”. In de andere studies werd niet gerapporteerd wanneer exact gestart werd met spoelen met chloorhexidine. Waarschijnlijk was dat net als in de twee andere studies daags na de operatie.
Kosten
Wat de kosten betreft gaat het om de vraag of het toepassen van de aanbevelingen een belangrijke verandering van de bestaande praktijk tot gevolg heeft. Deze vraag is echter moeilijk te beantwoorden omdat:
- Inzicht ontbreekt in de mate waarin überhaupt chloorhexidine door behandelaars wordt toegepast. Een beknopte inventarisatie van patiëntfolders die hier te lande door maatschappen van MKA-chirurgen zijn samengesteld, leert dat chloorhexidine (als spoelmiddel) niet altijd wordt voorgeschreven;
- Inzicht ontbreekt in welke mate de voorkeursaanbeveling (applicatie van chloorhexidine gel) kan worden gevolgd. Dit hangt immers af van de mate waarin de meeste patiënten na extractie van de derde molaar tot goede hygiëne in de gehele mond in staat zijn. Is dit vaak niet mogelijk door bijvoorbeeld zwelling dan zal veeleer chloorhexidine als spoelmiddel worden voorgeschreven, zo dit al voorgeschreven zou worden.
De kosten voor een verpakkingseenheid chloorhexidine als gel (50 gram) of als mondspoeling (200 ml) ontlopen elkaar nauwelijks: circa 6 euro.
Aanvaardbaarheid en haalbaarheid
Voor de meeste patiënten is applicatie van chloorhexidine in de extractie-alveole de preferente optie: minder last van bijwerkingen als verkleuring, veranderde of nare smaak, en minder behan-dellast omdat niet een aantal dagen hoeft te worden gespoeld.
De meeste behandelaars passen applicatie van chloorhexidine niet toe. Overigens schrijven ook niet alle behandelaars chloorhexidine als spoelmiddel voor, zo leert een beknopte inventarisatie van patiëntfolders die hier te lande door maatschappen van MKA-chirurgen zijn samengesteld. De aanvaardbaarheid van het appliceren met chloorhexidine gel of voorschrijven van chloorhexidine als spoelmiddel kan voor een deel van de behandelaars dan ook een probleem zijn.
Op zich is het appliceren van chloorhexidine gel haalbaar. In Nederland is de 1% concentratie en niet de 0,12% concentratie beschikbaar. Het vergt wat meer voorbereiding van de afspraak, zoals het klaarleggen van een monoject spuit met de gel. Met het toepassen van gel om het risico op alveolitis te verminderen is in Nederland weinig ervaring opgedaan.
Rationale
De werkgroep heeft vanwege een overeenkomstig effect van chloorhexidine als spoelmiddel en als gel veel gewicht toegekend aan het gebrek aan ervaring in Nederland met het toepassen van chloorhexidine als gel.
Overwegingen bij uitgangsvraag 5.3
+Kwaliteit van bewijs
De kwaliteit van bewijs is redelijk.
Waarden en voorkeuren
Gezien de lage kosten en grote beschikbaarheid kan het spoelen met kraanwater laagdrempelig uitgevoerd worden. Daar er ook geen bijwerkingen bekend zijn en het spoelen het risico op een alveolitis lijkt te reduceren zal de patiënt de voorkeur hebben om deze interventie toe te passen. Wel zal het voor de patiënt van belang zijn om een goede instructie te krijgen hoe het spuitje te gebruiken.
Balans van gewenste en ongewenste effecten
De NNT van 13 valt hoger uit dan de NNT=8 in geval van chloorhexidine. Anderzijds zijn ongunstige effecten van het gebruik van een monoject spuit met kraanwater afwezig. Dit in tegenstelling tot het gebruiken van chloorhexidine. Nochtans meent de werkgroep dat gegeven het feit dat de effecten van een monojectspuit met kraanwater slechts in één studie zijn onderzocht, het niet toelaat met enige zekerheid de balans van gunstige en ongunstige effecten te bepalen.
Kosten
In het licht van de kosten van behandeling van inflammatoire complicaties zijn de kosten voor gebruik van monoject injectiespuit om het risico op inflammatoire complicaties te verminderen verwaarloosbaar.
Rationale
Ondanks de lage kosten en het ontbreken van bijwerkingen heeft de werkgroep groot gewicht toegekend aan het feit dat slechts 1 RCT het effect van injectiespuit met kraanwater heeft geëvalueerd.
Onderbouwing bij uitgangsvraag 5.1
+Zoeken en selecteren
Er werd geen literatuursearch verricht vanwege de beschikbaarheid van twee systematische re-views die door de werkgroep werden aangedragen en van voldoende methodologische kwaliteit waren:
- Lodi G, Figini L, Sardella A, Carrassi A, Del Fabbro M, Furness S. Antibiotics to prevent complications following tooth extractions. Cochrane Database of Systematic Reviews 2012, Issue 11. Art.No.:CD003811.
- Marcussen KB, Laulund AS, Jørgensen HL, Pinholt EM. A Systematic Review on Effect of Single-Dose Preoperative Antibiotics at Surgical Osteotomy Extraction of Lower Third Molars. J Oral Maxillofac Surg. 2016 Apr;74(4):693-703.
Samenvatting literatuur
De review van Lodi et al. (2012) wordt gebruikt voor het samenvatten van de literatuur over het postoperatief of pre- én postoperatief toedienen van antibiotica versus placebo voor alle uit-komstmaten, en voor het preoperatief toedienen van antibiotica voor zover het de uitkomstmaten trismus, koorts, pijn, zwelling en bijwerkingen betreft. De review van Marcussen et al. (2016) voor het preoperatief toedienen van antibiotica versus placebo wordt gebruikt voor zover het de uitkomstmaten wondinfectie en alveolitis betreft. Wat de inclusiecriteria betreft zijn er twee verschillen tussen beide reviews: Lodi et al. (2012) hebben alleen gerandomiseerde trials met een dubbelblinde opzet geïncludeerd; Marcussen et al. (2016) hebben wel gerandomiseerde trials geïncludeerd die geen dubbelblinde opzet hadden, en verdisconteerden dit gegeven in de beoordeling van de risk of bias. Het voordeel van de ruimere inclusie is dat de precisie van de schatting kan worden vergroot doordat meerdere studies kunnen worden gecombineerd. Het tweede verschil tussen beide reviews is dat Marcussen et al. (2016) alleen studies includeerden wanneer tijdens het verwijderen van een derde molaar een osteotomie werd verricht. In de review van Lodi et al. (2012) wordt osteotomie niet als inclusie- of exclusiecriterium vermeld. Ook wordt dit niet vermeld bij de karakteristieken van geïncludeerde studies. Gezien de grote overlap in geïncludeerde studies werd in het overgrote deel van de studies een osteotomie verricht. In beide reviews betreft het vrijwel alleen studies waarin sprake was van verwijdering van een derde molaar in de onderkaak. Beide reviews voldoen in hoge mate aan de AMSTAR-criteria.
Preoperatief toedienen van antibiotica versus placebo
Wondinfectie
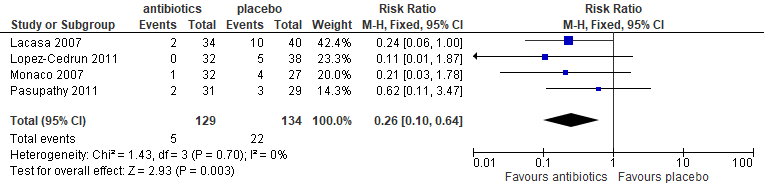
In 6 trials werd gerapporteerd over wondinfecties. Een wondinfectie werd gedefinieerd als puru-lente afvloed uit de wond, koorts en/of lymfadenopathie. Een alveolitis werd gedefinieerd als toename van pijn na dag 3, partieel of volledige afwezigheid van bloedstolsel in de alveole met of zonder halitose. In deze trials werd pre-operatief amoxicilline oraal (Lacasa 2007; Monaco 2009; López-Cedrún 2011; Pasupathy 2011; Bortoluzzi 2013), metronidazol (Pasupathy 2011) of penicilline intraveneus (Halpern 2007) als preantibioticum gebruikt. Voor frequentie en dosering van de medicatie zie bijlage 4. Het preoperatief geven van antibiotica verminderde het risico op een wondinfectie met bijna 80% significant (RR: 0,21; 95% BI: 0,09-0,49), ofwel van circa 11% naar circa 2% (figuur 5.1).
Figuur 5.1. Wondinfectie: preoperatief toedienen van antibiotica versus placebo

Een subgroepanalyse van 4 trials (Lacasa 2007; Monaco 2007; López-Cedrún 2011; Pasupathy 2011) waarin amoxicilline oraal werd gebruikt laat een significante reductie van 74% op het risico op een wondinfectie zien. In absolute termen is dit een reductie van ruim 11% (van 15,1% naar 3,5%; figuur 5.2).
Figuur 5.2. Wondinfectie: preoperatief toedienen van amoxicilline oraal versus placebo
Alveolitis
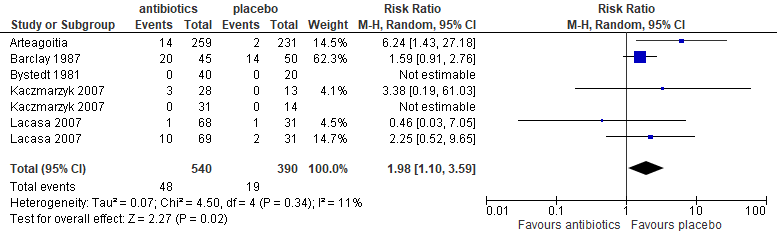
In 7 trials werd gerapporteerd over alveolitis. In deze trials werd amoxicilline oraal (López-Cedrún 2011; Bortoluzzi 2013), metronidazol (Ritzau 1992; Bergdahl 2004), penicilline V oraal (Krekmanov 1980, 1981) of penicilline intraveneus (Halpern 2007) gebruikt. Het preoperatief geven van antibiotica verminderde het risico op alveolitis met bijna 60% significant (RR: 0,42; 95% BI: 0,18-0,99), ofwel van circa 11% naar circa 5% (figuur 5.3).
Figuur 5.3. Alveolitis: preoperatief toedienen van antibiotica versus placebo
Subgroepanalyses waarin de effecten van amoxicilline oraal, penicilline V oraal en metronidazol oraal afzonderlijk werden geëvalueerd, liet alleen voor penicilline V oraal een significant effect zien (figuren 5.4, 5.5 en 5.6) op het risico op alveolitis.
Figuur 5.4. Alveolitis: preoperatief toedienen van amoxicilline versus placebo
Figuur 5.5. Alveolitis: preoperatief toedienen van penicilline V oraal versus placebo
Figuur 5.6. Alveolitis: preoperatief toedienen van metronidazol versus placebo
Postoperatieve pijn t/m dag 7
Alleen Sekhar 2001 rapporteerde over postoperatieve pijn. Metronidazol had geen significant effect op het risico op pijn (RR: 0,97; 95% BI: 0,53-1,76).
Koorts t/m dag 7
Lacasa 2007 was de enige studie die over koorts rapporteerde. In deze studie waren alle patiënten op dag 7 vrij van koorts.
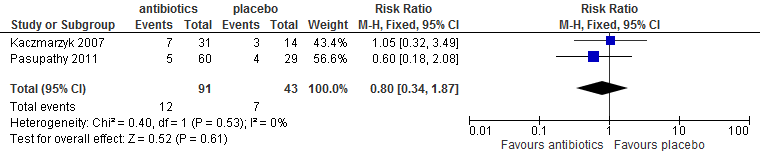
Zwelling t/m dag 7
In drie trials (Sekhar 2001; Kaczmarzyk 2007; López-Cedrún 2011) werd gerapporteerd over zwelling. Metronidazol, clindamycine of amoxicilline werd als antibiotica toegediend. Deze antibiotica lijken zwelling niet te verminderen (figuur 5.7).
Figuur 5.7. Zwelling: preoperatief toedienen van antibiotica versus placebo
Trismus t/m dag dag 7
In twee trials (Kaczmarzyk 2007; Pasupathy 2011) werd gerapporteerd over trismus. Clindamycine of amoxicilline werd als antibioticum toegepast. Deze antibiotica lijken een gunstig, ofschoon niet significant effect te hebben op het risico op trismus (figuur 5.8).
Figuur 5.8. Trismus: preoperatief toedienen van antibiotica versus placebo
Bijwerkingen
In vijf trials (Bystedt et al., 1981; Barclay et al., 1987; Arteagoitia et al., 2005; Kaczmarzyk et al., 2007; Lacasa et al., 2007) werd gerapporteerd over bijwerkingen. Gerapporteerd werden: braken, maagpijn, diarree. Het risico op bijwerkingen was als gevolg van antibioticagebruik verdubbeld (figuur 5.9).
Figuur 5.9. Bijwerkingen: pre- en/of postoperatief toedienen van antibiotica versus placebo
Opmerking: sommige studies hadden drie groepen die onderling vergeleken werden. Om deze reden komen sommige studies twee keer voor.
Kwaliteit van bewijs
Voor twee uitkomstmaten (alveolitis, pijn t/m dag 7) is er redelijke kwaliteit van bewijs. Voor alle andere uitkomstmaten is er lage kwaliteit van bewijs. Redenen om de kwaliteit van bewijs af te waarderen waren meestal gebrek aan precisie vanwege een gering aantal ‘events’ en risico op vertekening vanwege relatief veel uitvallers en onduidelijke of ondeugdelijke blindering van de toewijzing aan experimentele of controlegroep. Zie bijlage 13 voor nadere details.
Conclusies
| Redelijk GRADE |
Alveolitis, pijn t/m dag Preoperatief toedienen van antibiotica vermindert waarschijnlijk het risico op alveolitis. Preoperatief toedienen van antibiotica heeft waarschijnlijk geen effect op het risico op pijn op dag 7.Lodi et al, 2012; Marcussen et al.,2016 |
| Laag GRADE |
Wondinfectie, koorts t/m dag 7, zwelling t/m dag 7, trismus t/m dag 7, bijwerkingen Preoperatief toedienen van antibiotica zou kunnen resulteren in een kleine ver-mindering van het risico op een wondinfectie. Het effect van preoperatief toedienen van antibiotica op koorts, zwelling, trismus en bijwerkingen is onzeker.Lodi et al, 2012; Marcussen et al.,2016 |
Postoperatief toedienen van antibiotica versus placebo
Wondinfectie
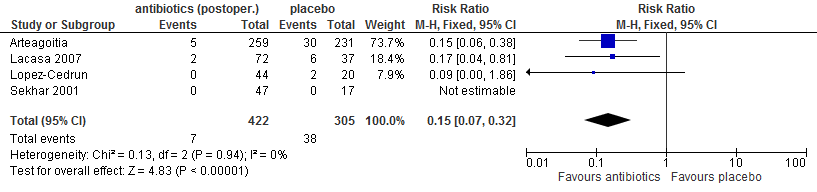
In vier trials (Sekhar 2001; Arteagoitia 2005; Lacasa 2007; López-Cedrún 2011) werd gerapporteerd over wondinfecties. Alle studies betroffen verwijdering van een derde molaar in de onderkaak. In één studie werd metronidazol (Sekhar 2001) gegeven, in twee studies amoxicilline/clavulaanzuur (Arteagoitia 2005; Lacasa 2007) en in één studie amoxicilline (López-Cedrún 2011). Toediening van antibiotica reduceerde het risico op een wondinfectie met 85% (RR: 0.15; 95% BI 0.07 – 0.32; figuur 5.10). In absolute termen komt dit neer op een vermindering met 11% (95% BI: 7-15%).
Figuur 5.10. Wondinfecties: postoperatief toedienen van antibiotica versus placebo
Alveolitis
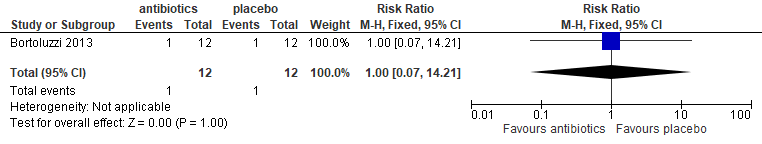
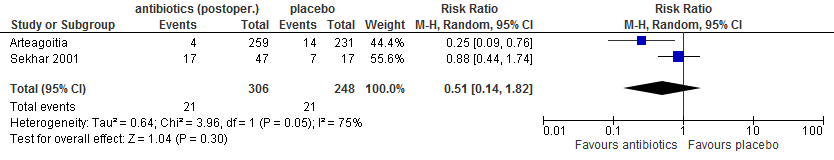
In twee trials (Arteagoitia 2005; López-Cedrún 2011) werd gerapporteerd over alveolitis. In beide studies werd amoxicilline/clavulaanzuur als antibioticum gebruikt. Eén van deze studies betrof derde molaren in de onderkaak. Vanwege het geringe aantal ‘events’ (n=2) is geen uitspraak te doen in hoeverre postoperatief toedienen van antibiotica het risico op alveolitis verminderden (figuur 5.11).
Figuur 5.11. Alveolitis: postoperatief toedienen van antibiotica versus placebo
Postoperatieve pijn t/m dag 7
In twee trials (Sekhar 2001; Arteagoitia 2005) werd gerapporteerd over de aan- of afwezigheid van pijn. Zoals figuur 5.12 laat zien was er een groot verschil tussen beide studies in de mate waarin antibiotica pijn verminderden. Mogelijk heeft dit als oorzaak dat verschillende antibiotica werden gebruikt: amoxicilline/clavulaanzuur (breedspectrum) en metronidazol (alleen actief tegen anaerobe bacteriën).
Figuur 5.12. Postoperatieve pijn: postoperatief toedienen van antibiotica versus placebo
Koorts t/m dag 6-7
In één studie (Arteagoitia 2005) werd gerapporteerd over koorts (temperatuur >37,88). In deze studie werd amoxicilline/clavulaanzuur als antibioticum toegepast. Dit antibioticum reduceerde koorts met bijna 90% (RR: 0,11; 95% BI: 0,01; 0,88): in absolute termen een reductie van 3,5% (van 3,5% naar 0.0%).
Zwelling t/m dag 7
In één studie (Sekhar 2001) werd gerapporteerd over zwelling. In deze studie werd metronidazol als antibioticum toegepast. Dit antibioticum had geen statistisch significant effect op zwelling, al wijst de puntschatter op een reductie van circa 50% (RR: 0,50; 95% BI: 0,24; 1,02): in absolute termen een reductie van 24% (van 47% naar 23%).
Trismus t/m dag 7
Geen van de studies rapporteerde over trismus.
Bijwerkingen
Zie figuur 5.9.
Kwaliteit van bewijs
De kwaliteit van bewijs is laag voor alle uitkomstmaten vanwege de relatieve kleine studieomvang waardoor de uitkomsten onnauwkeurig zijn en relatief hoge percentages uitvallers. Zie bijlage 13 voor nadere details.
Conclusies
| Laag GRADE |
Wondinfectie, alveolitis, koorts, zwelling, trismus en pijn t/m dag 7, bijwerkingen Postoperatief toedienen van antibiotica zou het risico op een wondinfectie en koorts op dag 7 kunnen verminderen. Het effect van postoperatief toedienen van antibiotica op alveolitis, pijn en zwelling op dag 7 is onzeker. Postoperatief toedienen van antibiotica zou het risico op bijwerkingen kunnen vergroten.Lodi et al., 2012; Marcussen et al.,2016 |
Pre- én postoperatief toedienen van antibiotica versus placebo
Wondinfectie
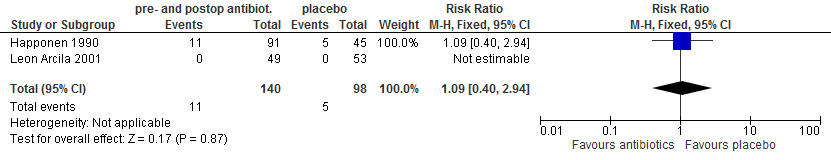
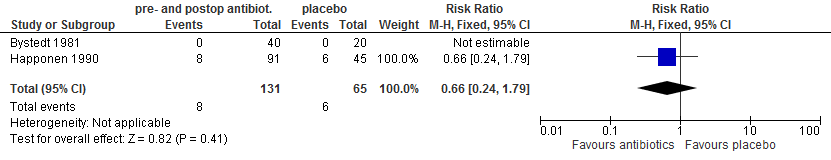
In twee trials (Happonen 1990; Leon Arcila 2001) werd gerapporteerd over wondinfecties. In beide studies werd niet gerapporteerd of het derde molaren in onder- of bovenkaak betrof. In de ene studie (Happonen 1990) werd tinidazol, in de andere studie (Leon Arcila 2001) amoxicilline als antibioticum gebruikt. Er was geen statistisch significant verschil tussen antibioticum en placebo (figuur 5.13).
Figuur 5.13. Wondinfecties: pre- én postoperatief toedienen van antibiotica versus placebo
Alveolitis
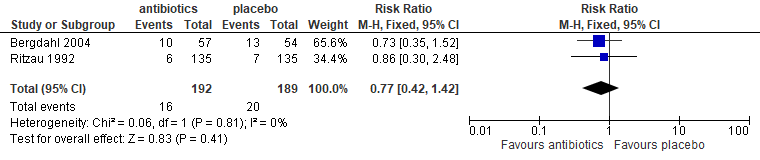
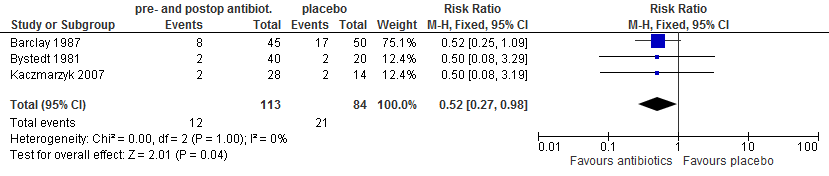
In drie trials (Bystedt 1981; Barclay 1987; Kaczmarzyk 2007) werd gerapporteerd over alveolitis. De toegepaste antibiotica waren metronidazol (Barclay 1987) en clindamycine (Bystedt 1981; Kaczmarzyk 2007). Deze antibiotica gaven een risicoreductie van bijna 50% (RR: 0,52; 95% BI: 0,27 – 0,98; figuur 5.14): in absolute termen een reductie van 14% (van 25% naar 11%).
Figuur 5.14. Alveolitis: pre- én postoperatief toedienen van antibiotica versus placebo
Postoperatieve pijn t/m dag 6-7
In slechts één studie (Bystedt 1981) werd gerapporteerd over postoperatieve pijn. In deze studie werd clindamycine als antibioticum toegepast. Het risico op postoperatieve pijn werd met meer dan 60% verminderd door dit antibioticum (RR:0,36; 95% BI: 0,13-0,98).
Koorts t/m dag 7
In twee trials (Bystedt 1981; Happonen 1990) werd gerapporteerd over koorts. In deze studies werd tinidazol (Happonen 1990) of clindamycine (Bystedt 1981) als antibiotica toegepast. In één van de trials werd bij niemand koorts waargenomen. De andere trial liet een niet significante vermindering van het risico op koorts zien bij toepassen van tinidazol (figuur 5.15).
Figuur 5.15. Koorts: pre- én postoperatief toedienen van antibiotica versus placebo
Zwelling t/m dag 7
In twee trials (Kaczmarzyk 2007; López-Cedrún 2011) werd gerapporteerd over zwelling. In deze studies werd clindamycine (Kaczmarzyk 2007) of amoxicilline (López-Cedrún 2011) als antibioticum toegepast. Toedienen van deze antibiotica had geen significant effect op het optreden van zwelling (figuur 5.16).
Figuur 5.16. Zwelling: pre- én postoperatief toedienen van antibiotica versus placebo
Trismus t/m dag 7
In slechts één studie (Kaczmarzyk 2007) werd gerapporteerd over trismus. Er werd geen statistisch significant effect van clindamycine waargenomen (RR: 0,93; 95% BI: 0,27-3,14].
Bijwerkingen
Zie figuur 5.9.
Kwaliteit van bewijs
De kwaliteit van bewijs is (zeer) laag voor alle uitkomstmaten vanwege de relatieve kleine studieomvang waardoor de uitkomsten onnauwkeurig zijn, en relatief hoge percentages uitvallers. Zie bijlage 4 voor nadere details.
Conclusies
| Laag tot zeer laag GRADE |
Wondinfectie, alveolitis. Pijn, koorts zwelling en trismus t/m dag 7, bijwerkingen Pre- en postoperatief toedienen van antibiotica vermindert het risico op een wondinfectie mogelijk niet. Pre- en postoperatief toedienen van antibiotica vermindert wellicht het risico op alveolitis en pijn t/m dag 7. Het effect van pre- en postoperatief toedienen van antibiotica op koorts, zwelling, trismus en bijwerkingen is onzeker.Lodi et al., 2012; Marcussen et al.,2016 |
Onderbouwing bij uitgangsvraag 5.2
+Zoeken en selecteren
Voor het beantwoorden van de vraag ‘Is chloorhexidine effectief in het voorkomen van complicaties na het verwijderen van verstandskiezen?’ heeft de werkgroep zelf geen systematische review verricht maar gebruik gemaakt van een zeer recente systematische review en meta-analyse (Rodríguez Sánchez et al. 2017).
Samenvatting literatuur
De review van Rodríguez Sánchez et al. (2017) had tot doel:
- De incidentie van postoperatieve alveolitis na verwijdering van een derde molaar te onder-zoeken onder patiënten bij wie voor, tijdens én/of na de extractie al dan niet chloorhexidine werd toegepast;
- De werkzaamheid van gel en mondspoeling te vergelijken ten opzichte van een placebo product.
In totaal werden 18 studies geïncludeerd, waaronder 2 met een split-mouth opzet, waarvan 16 met extracties van een derde molaar in de onderkaak en 2 met extracties in zowel onder- als bovenkaak (Hermesch et al., 1998; Abu-Mostafa et al., 2015). Deze betroffen in totaal 2.824 extracties. In deze onderzoeken was er globaal (percentage vrouwen was 55) een gelijke verdeling tussen mannen en vrouwen. De gemiddelde leeftijd varieerde van 21 tot 33 jaar. In 13 van de 18 studies werden rokers geïncludeerd. In 6 studies werd de door Blum (2002) voorgestelde definitie van alveolitis gehanteerd (zie de inleiding voor de definitie). In de andere studies werden definities gehanteerd die hiermee overeenkomsten vertoonden. In 5 studies werd chloorhexidine als mondspoeling vergeleken met een placebo. Drie van de 5 studies gebruikten 0,12% chloorhexidine 7 dagen voor en 7 dagen na verwijdering van de derde molaar. Een van de 5 studies gebruikte 0,20% chloorhexidine 7 dagen voor en 7 dagen na verwijdering van de derde molaar. Een van de 5 studies gebruikte 0,20% chloorhexidine 1 minuut voor het verwijderen van de derde molaar. In 2 studies werd chloorhexidine als mondspoeling vergeleken met een zoutoplossing. In 1 van de 2 studies betrof het 0,12% chloorhexidine 0,5-1 minuut voor het verwijderen van de derde molaar. In 1 van de 2 studies betrof het 0,20% chloorhexidine 0,5-1 minuut voor het verwijderen van de derde molaar. In 1 studie werd het toepassen van chloorhexidine 7 dagen voor en 7 dagen na het verwijderen van de derde molaar vergeleken met toepassen van chloorhexidine 7 dagen na het verwijderen van de derde molaar. In 7 studies werd 0,2% chloorhexidine als gel (intra-alveolair) vergeleken met een placebo. In 1 studie werden 0,2% en 1% chloorhexidine als gel (7 dagen postoperatief) vergeleken. In 2 studies werden 0,12% chloorhexidine als mondspoeling vergeleken met 0,2% chloorhexidine als gel (7 dagen postoperatief). De belangrijkste kenmerken van de studies zijn samengevat in bijlage 4. In hun meta-analyse combineerden Rodríguez Sánchez et al. (2017) alle studies waarin chloor-hexidine als mondspoeling of als gel werd toegepast zonder rekening te houden met mogelijke effecten van verschillende concentraties van chloorhexidine, duur van toepassen en of toepassen voor en/of na verwijderen van de derde molaar plaatsvond. De werkgroep heeft daarom besloten een nieuwe meta-analyse te verrichten waarbij subgroepen werden geïntroduceerd voor toepassingsduur etc.
Chloorhexidine als mondspoeling versus placebo
Alveolitis
Het gecombineerde effect van de 5 studies die chloorhexidine als mondspoeling versus placebo onderzochten komt neer op een vermindering van het risico op alveolitis met 43% (RR: 0,57; 95% BI: 0,41-0,78; figuur 5.17). In absolute termen komt dit er op neer dat bij een groep van 8 personen 1 incident van alveolitis minder optreedt in vergelijking met de controlegroep (number needed to treat (NNT) is 8, 95% BI: 5-18). Vergelijking 2.1.1 (7 dagen preoperatief en 7 dagen postoperatief spoelen) en vergelijking 2.1.2 (halve minuut preoperatief en 7 dagen postoperatief spoelen), die beide een statistisch significante uitkomst geven, kunnen gebruikt worden om te beoordelen of 7 dagen preoperatief spoelen effectiever is dan een halve minuut preoperatief spoelen. Er blijkt geen statistisch significant verschil te zijn (relatief risico [halve minuut versus 7 dagen preoperatief]: 1,55; 95% BI: 0,83-2,89). Berekenen we de NNT voor de vier studies waarin in ieder geval 7 dagen na verwijdering van de derde molaar chloorhexidine als mondspoeling werd gebruikt, én waarbij minimaal een halve minuut voor verwijderen met chloorhexidine werd gespoeld, dan komt de NNT uit op: 8 (95% BI: 5-20).
Figuur 5.17. Effect van chloorhexidine (mondspoeling) versus placebo op risico van alveolitis
Ter informatie: Hermesch et al. (1998) betrokken in hun onderzoek derde molaren in onder- en bovenkaak, maar rapporteerden niet of er verschillen in uitkomsten waren.
Bijwerkingen
In 2 van de 5 studies werd niet gerapporteerd over het al dan niet optreden van bijwerkingen. In 2 studies werden geen ernstige bijwerkingen gesignaleerd. In 1 studie (Hermesch et al., 1998) werd glossitis (placebogroep) en stomatis (chloorhexidinegroep) gerapporteerd. Ragno & Szkutnik (1981) rapporteerden dat 3 van de 40 patiënten klaagden over een nare smaak van het spoelmiddel met 0,12% chloorhexidine.
Kwaliteit van bewijs
De kwaliteit van bewijs is redelijk voor de uitkomstmaat alveolitis. Er werd niet afgewaardeerd voor ernstige risk of bias al waren 3 studies niet geblindeerd, en werd in 4 studies het genereren van de randomisatievolgorde niet gerapporteerd. Er werd evenmin afgewaardeerd voor inconsistentie, indirect bewijs en publicatiebias. Wel werd afgewaardeerd voor onnauwkeurigheid omdat de optimal information size (200-300 events) met 127 events (figuur 1) niet werd gehaald. De kwaliteit van bewijs met betrekking tot bijwerkingen is laag. Er werd afgewaardeerd voor zeer ernstige risk of bias omdat er duidelijk sprake is van selectieve uitkomstrapportage. Er werd niet afgewaardeerd voor inconsistentie, indirect bewijs, onnauwkeurigheid en publicatiebias.
Chloorhexidine als mondspoeling versus zoutoplossing
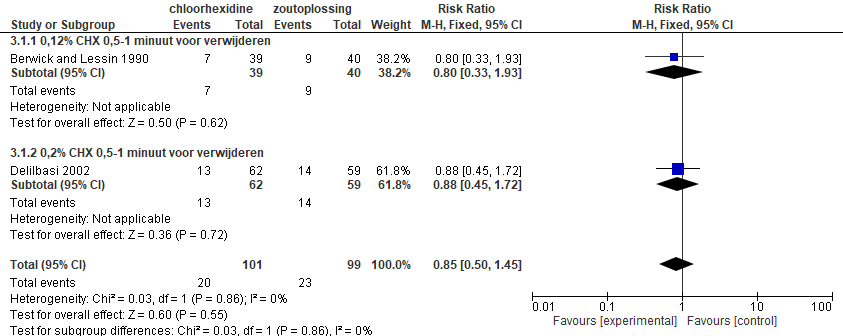
Alveolitis
Het gecombineerde effect van de 2 studies die chloorhexidine vergeleken met een zoutoplossing komt neer op een vermindering van het risico op alveolitis met 15% (RR: 0,85; 95% BI: 0,50-1,45; figuur 5.18). Het effect is echter niet statistisch significant. Tussen verschillende concentraties lijkt geen verschil in effect te zijn.
Figuur 5.18. Effect van chloorhexidine (mondspoeling) versus zoutoplossing op risico van alveolitis
Bijwerkingen
In 1 van de 2 studies werd niet gerapporteerd over het al dan niet optreden van bijwerkingen. Delilbasi et al. (2002) rapporteerden als belangrijke klachten over chloorhexidine verkleuring van de gebitselementen en de orale mucosa, verandering van smaakbeleving en de nare smaak van het spoelmiddel.
Kwaliteit van bewijs
De kwaliteit van bewijs is laag voor de uitkomstmaat alveolitis. Er werd niet afgewaardeerd voor ernstige risk of bias al was 1 studie niet geblindeerd, en werd in 1 studie het genereren van de randomisatievolgorde niet gerapporteerd. Er werd evenmin afgewaardeerd voor inconsistentie, indirect bewijs en publicatiebias. Wel werd afgewaardeerd voor zeer ernstige onnauwkeurigheid omdat de optimal information size (300 events) met 43 events (figuur 5.17) niet werd gehaald. De kwaliteit van bewijs met betrekking tot bijwerkingen is laag. Er werd afgewaardeerd voor zeer ernstige risk of bias omdat er naast de in de vorige alinea genoemde beperkingen duidelijk sprake is van selectieve uitkomstrapportage. Er werd niet afgewaardeerd voor inconsistentie, indirect bewijs, onnauwkeurigheid en publicatiebias.
0,2% chloorhexidine als mondspoeling gedurende 7 dagen pre- en 7 dagen postoperatief versus chloorhexidine als mondspoeling gedurende 7 dagen postoperatief.
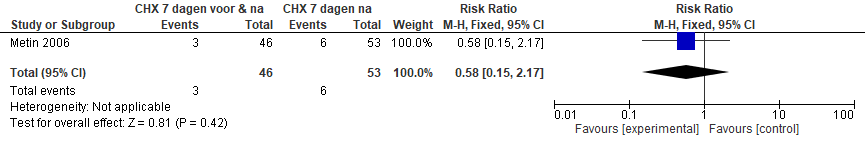
Alveolitis
De studie van Metin et al. (2006) suggereert dat 7 dagen pre- en 7 dagen postoperatief spoelen effectiever is dan 7 dagen postoperatief spoelen. Dit effect is echter niet statistisch significant (figuur 5.19).
Figuur 5.19. Effect van chloorhexidine (mondspoeling) 7 dagen pre- en postoperatief versus 7 dagen postoperatief op risico van alveolitis
Bijwerkingen
In studie van Metin et al. (2006) werd niet gerapporteerd over het al dan niet optreden van bij-werkingen.
Kwaliteit van bewijs
De kwaliteit van bewijs is laag voor de uitkomstmaat alveolitis. Er werd niet afgewaardeerd voor risk of bias, al werd noch het percentage uitvallers noch het genereren van de randomisatievolgorde gerapporteerd. Er werd niet afgewaardeerd voor inconsistentie, indirect bewijs en publicatiebias. Er werd wel afgewaardeerd voor zeer ernstige onnauwkeurigheid omdat de optimal information size (300 events) met 9 events (figuur 5.19) niet werd gehaald. De kwaliteit van bewijs is laag voor de uitkomstmaat bijwerkingen: er is evident sprake van selectieve uitkomstrapportage.
Chloorhexidine als gel (0,2%; intra-alveolair) versus placebo
Alveolitis
Het gecombineerde effect van de 7 studies die chloorhexidine als gel versus placebo onderzochten komt neer op een vermindering van het risico op alveolitis met 49% (RR: 0,51; 95% BI: 0,38-0,70; figuur 5.20). In absolute termen komt dit er op neer dat bij een groep van 8 personen 1 incident van alveolitis minder optreedt in vergelijking met de controlegroep (number needed to treat (NNT) is 8 95% BI: 5-14).
Figuur 5.20. Effect van chloorhexidine (gel; 0,2% intra-alveolair) versus placebo op risico van alveolitis
Bijwerkingen
In 3 van de 7 studies werd niet gerapporteerd over het al dan niet optreden van bijwerkingen. In de overige studies werden geen ernstige bijwerkingen gesignaleerd.
Kwaliteit van bewijs
De kwaliteit van bewijs voor de uitkomstmaat alveolitis is redelijk. Er werd niet afgewaardeerd voor risk of bias al was 1 studie niet geblindeerd, werd in 3 studies het genereren van de randomisatievolgorde niet gerapporteerd, en werd in 3 studies het aantal uitvallers niet gerapporteerd. Er werd niet afgewaardeerd voor inconsistentie, indirect bewijs en publicatiebias. Wel werd afgewaardeerd voor ernstige onnauwkeurigheid omdat de optimal information size (300 events) met 153 events (figuur 5.20) niet werd gehaald. De kwaliteit van bewijs voor de uitkomstmaat bijwerkingen is laag omdat er evident sprake is van selectieve uitkomstrapportage.
Chloorhexidine als gel (1%; intra-alveolair) versus chloorhexidine als gel (0,2%; intra-alveolair)
Alveolitis
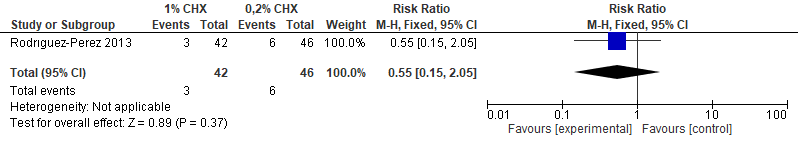
De studie van Rodriguez-Perez et al. (2013) suggereert dat 1% chloorhexidine effectiever is dan 0,2% chloorhexidine. Dit effect is echter niet statistisch significant (figuur 5.21).
Figuur 5.21. Effect van chloorhexidine (gel; 1% intra-alveolair) versus chloorhexidine (gel; 0,2% intra-alveolair)
Bijwerkingen
Er werden geen ernstige bijwerkingen gerapporteerd.
Kwaliteit van bewijs
De kwaliteit van bewijs voor de uitkomstmaat alveolitis is laag. Er werd niet afgewaardeerd voor risk of bias, indirect bewijs, inconsistentie en publicatiebias. Er werd wel afgewaardeerd voor zeer ernstige onnauwkeurigheid omdat de optimal information size (300 events) met 9 events (figuur 5.21) niet werd gehaald. De kwaliteit van bewijs voor de uitkomstmaat bijwerkingen is laag omdat er evident sprake is van selectieve uitkomstrapportage.
Chloorhexidine (mondspoeling) versus chloorhexidine (gel)
Alveolitis
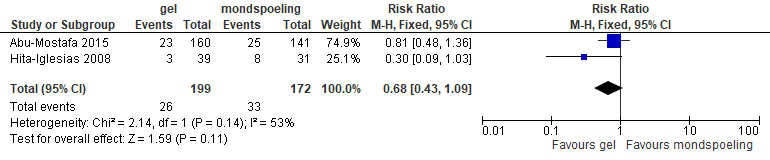
Het gecombineerde effect van de 2 studies die chloorhexidine als gel versus chloorhexidine als spoelmiddel onderzochten komt neer op een vermindering van het risico op alveolitis met 32% (RR: 0,68; 95% BI: 0,43-1,09; figuur 5.22). Dit effect is echter niet statistisch significant. Opgemerkt moet worden dat in Hita-Iglesias et al. (2008) de gel plaatselijk 2x daags gedurende 7 dagen werd aangebracht, terwijl in Abu-Mostafa et al. (2015) de gel intra-alveolair werd toegepast. Dit zou de inconsistente uitkomsten kunnen verklaren. Het is echter ook mogelijk dat de uitkomst in Hita-Iglesias et al. (2008) een ‘uitbijter’ is gezien het zeer geringe aantal events. Nog een andere mogelijkheid is dat de verschillende onderzoeksresultaten van doen hebben met het feit dat Abu-Mostafa et al. (2015) zowel derde molaren in de onder- en bovenkaak includeerden, en Hita-Iglesias et al. (2008) alleen derde molaren in de onderkaak in hun onderzoek betrokken. Abu-Mostafa et al. (2015) rapporteerden evenwel dat er geen significant verschil in de uitkomsten was tussen derde molaren in onder- en bovenkaak.
Figuur 5.22. Effect van chloorhexidine (gel: 7 dagen postoperatief of direct na extractie 0,2% CHX) versus chloorhexidine (mondspoeling 7 dagen postoperatief; 0,12% CHX) op risico van alveolitis
Bijwerkingen
Er werd niet gerapporteerd over het al dan niet optreden van bijwerkingen.
Kwaliteit van bewijs
De kwaliteit van bewijs voor de uitkomstmaat alveolitis is redelijk. Er werd niet afgewaardeerd voor risk of bias, indirect bewijs, publicatiebias. Er werd wel afgewaardeerd voor ernstige on-nauwkeurigheid omdat de optimal information size (300 events) met 59 events (figuur 5.22) niet werd gehaald. Tevens werd afgewaardeerd voor inconsistentie (I2>50%) De kwaliteit van bewijs voor de uitkomstmaat bijwerkingen is laag omdat er evident sprake is van selectieve uitkomstrapportage.
Conclusies
| Redelijk GRADE |
Alveolitis Toepassen van 0,12-0,2% chloorhexidine als mondspoeling 7 dagen of een halve minuut preoperatief én 7 dagen na verwijdering van een derde molaar vermindert waarschijnlijk het risico op alveolitis aanzienlijk in vergelijking met een placebo. Er zijn onvoldoende studies om een uitspraak te doen over de relatieve effectiviteit van 0,12 en 0,2% chloorhexidine voor zover het vermindering van het risico op alveolitis betreft.Hermesch et al., 1998; Larsen et al., 1990; Ragno & Szkulnik 1991; Krekmanov et al., 1986; Tjernberg et al., 1979 |
| Laag GRADE |
Alveolitis Het is onzeker in welke mate het effect van 0,12% of 0,2% chloorhexidine, 1 minuut voor het verwijderen van een derde molaar gegeven, verschilt van het effect van een zoutoplossing op vermindering van het risico op alveolitis.Delilbasi et al., 2002; Berwick & Lessin, 1990 |
| Laag GRADE |
Alveolitis Het is onzeker in welke mate het toepassen van 0,2% chloorhexidine gedurende 7 dagen voor en 7 dagen na het verwijderen van een derde molaar het risico op alveolitis meer vermindert dan alleen postoperatief toepassen ervan.Metin et al., 2006 |
| Redelijk GRADE |
Alveolitis Toepassen van chloorhexidine als gel (0,2%; intra-alveolair) na verwijdering van een derde molaar vermindert waarschijnlijk het risico op alveolitis aanzienlijk in vergelijking met een placebo.Feudenthal et al., 2015; Rubio-Palau et al., 2015; Haraji et al., 2015, 2013; Babar et al., 2012; Torres-Lagares et al., 2010, 2006 |
| Laag GRADE |
Alveolitis Het is onzeker in welke mate het toepassen van 1% chloorhexidine (intra-alveolair) als gel gedurende na verwijdering van een derde molaar het risico op alveolitis meer vermindert dan 0,2% chloorhexidine als gel.Rodriguez-Perez et al., 2013 |
| Laag GRADE |
Alveolitis Het toepassen van chloorhexidine als gel (intra-alveolair of topisch) na verwijdering van een derde molaar lijkt het risico op alveolitis meer te verminderen dan 0,12% chloorhexidine als mondspoeling 7 dagen postoperatief.Abu-Mostafa et al., 2015; Hita-Iglesias et al., 2008 |
| Laag GRADE |
Bijwerkingen In de meeste studies werden geen ernstige bijwerkingen gezien, maar er was evident sprake van selectieve rapportage: veel studies rapporteerden namelijk niet of er wel of geen bijwerkingen waren opgetreden. Voor zover bijwerkingen werden gerapporteerd, betrof dat het optreden van smaakverandering of nare smaak van chloorhexidine als spoelmiddel.Ragno & Szkutnik, 1981; Delilbasi et al., 2002 |
Onderbouwing bij uitgangsvraag 5.3
+Zoeken en selecteren
Voor het beantwoorden van de vraag ‘Is het postoperatief spoelen van de alveole m.b.v. een monoject spuit effectief in het voorkomen van complicaties na het verwijderen van derde molaren?’ heeft de werkgroep geen systematische review verricht vanwege de beschikbaarheid van een zeer recente randomized controlled trial, de eerste en tot dusverre enige studie waarin deze vraag is onderzocht (Ghaeminia et al., 2017).
Samenvatting literatuur
De studie van Ghaeminia et al. (2017) had tot doel:
- Het effect van het postoperatief irrigeren van de alveole met kraanwater door gebruik van een Monoject® injectiespuit op postoperatieve complicaties na verwijdering van een derde molaar in de onderkaak;
- Het effect van wondinfectie en alveolitis op de kwaliteit van leven te evalueren en risicofactoren geassocieerd met deze complicaties te identificeren.
In totaal werden 280 patiënten met 333 derde molaren geïncludeerd. Hiervan waren 220 molaren van vrouwen en 112 molaren van mannen. De verdeling naar sekse (v/m) over de interventie- en de controlegroep was 1,7 respectievelijk 2,2. In de interventiegroep is 31% ouder dan 26 jaar; in de controlegroep is het overeenkomstige cijfer 32%. In de interventiegroep kreeg de patiënt een Monoject® injectiespuit met kromme punt (12 cm3). Naast de reguliere instructies voor postoperatieve zorg kreeg de patiënt instructie hoe de injectiespuit te gebruiken: door de punt van de spuit naar de distale zijde van de tweede molaar in of boven de alveole te brengen en viermaal daags met lauw kraanwater te irrigeren. Om vroegtijdige verwijdering van het bloedstolsel te vermijden werd de patiënt geïnstrueerd 48 uur na de ingreep met irrigeren te starten tot aan het eerste bezoek 7 dagen later. Ruim een derde van de patiënten blijkt echter niet in staat tot een adequate irrigatietechniek! In de controlegroep kreeg de patiënt reguliere instructies voor postoperatieve zorg: gedurende 30 minuten op een gaasje bijten, niet spoelen en spugen gedurende de eerste 24 uur, en regulier poetsen van de tanden daags na de ingreep. Gebruik van paracetamol (4xd/1000 mg) in combinatie met ibuprofen (3x d/600 mg) werd postoperatief voorgeschreven. De primaire uitkomstmaat is het aantal derde molaren in de onderkaak met postoperatieve inflammatoire complicaties, bestaande uit wondinfecties en alveolitis. Een wondinfectie werd gedefinieerd als de aanwezigheid van een lokaal abces, ontstaan van faciaal of cervicaal abces / cellulitis, en andere tekenen die een infectie suggereren, zoals roodheid, zwelling, pusvorming en koorts. Alveolitis werd gedefinieerd volgens Blums criteria: postoperatieve pijn in en rond de plaats van extractie, die tussen 1 en 3 dagen na de ingreep in hevigheid toeneemt en gepaard gaat met een gedeeltelijk of geheel uiteenvallen van het bloedstolsel in alveole, met of zonder halitose. Secundaire uitkomstmaten waren: pijn gemeten een VAS-score, trismus (verandering in de maximale afstand tussen incisieven), OHIP-14 en gemiste werk- of studiedagen.
Postoperatieve inflammatoire complicaties
Op basis van een intention-to-treat analyse bleek de incidentie van inflammatoire complicaties in de interventiegroep 11,4% en in de controlegroep 19,4% te zijn. Dit verschil van 8,0% (95% BI: 0,4%-15,7%) correspondeert met een number needed to treat van 13 (95% BI: 6,4–276,9). Vooral het risico op alveolitis wordt verminderd door het irrigeren met water.
Pijn, trismus, OHIP-14 en gemiste werk- of studiedagen
Ghaeminia et al. (2017) zijn nagegaan in welke mate postoperatieve complicaties waren geassocieerd met pijn, trismus, mondgezondheid gerelateerde kwaliteit van leven, en het missen van werk- of studiedagen. Omdat de scores op de uitkomstmaten ‘an sich’ weinig informatief zijn over de grootte van het effect, heeft de werkgroep de scores omgerekend naar een Cohen’s D, een maat voor effectgrootte. De conventie is om bij een Cohen’s D van 0,80-1,29 van een groot effect te spreken, van een middelgroot effect in geval van 0,50-0,79 en van een klein effect in geval van 0,20-0,49. Voor de meeste uitkomstmaten is sprake van een groot effect (tabel 5.1).
Tabel 5.1. Grootte van effect (Cohen’s D) van inflammatoire complicaties na extractie derde molaar in de onderkaak op kwaliteit van leven uitkomstmaten
| Uitkomstmaat | Cohen’s D |
| Pijn | 1,13 |
| OHIP-14 (dag 1–7) Functionele beperkingen |
0,84 |
| Fysieke pijn | 0,55 |
| Psychisch ongemak | 1,11 |
| Fysiek onvermogen | 0,76 |
| Psychisch onvermogen | 0,88 |
| Sociaal onvermogen | 0,86 |
| Handicap | 0,92 |
| Trismus | 0,86 |
| Aantal gemiste werk- of studiedagen | 0,52 |
Bron: Ghaeminia et al. (2017). Berekening Cohen’s D door de werkgroep
Risicofactoren geassocieerd met inflammatoire complicaties
Ghaeminia et al. (2017) hebben door middel van multivariate analyse waarbij werd gecorrigeerd voor het al of niet gebruiken van een injectiespuit, leeftijd, sekse, verwijdering van bot, mate van impactie tot buurelement, en hoeveelheid debris in de alveole, geanalyseerd wat significante risicofactoren zijn. De volgende factoren blijken een significante risicofactor (tabel 5.2):
Tabel 5.2. Risicofactoren voor inflammatoire complicaties na verwijdering van derde molaar in de onderkaak
| Aanwezige risicofactor | Odds | ratio (95% BI) |
| Vrouwelijk geslacht | 5,59 | (2,17–14,41) |
| Leeftijd >26 jaar | 2,13 | (1,04–4,36) |
| Botverwijdering | 2,86 | (1,08–7,56) |
| Diep geïmpacteerde derde molaren | 3,77 | (1,07–13,3) |
| Minder ervaren operateur | 2,20 | (1,11–4,33) |
| Grote hoeveelheid debris op de plaats van extractie | 4,87 | (1,91–12,4) |
Bron: Ghaeminia et al. (2017)
Kwaliteit van bewijs
De kwaliteit van bewijs voor de primaire uitkomstmaat inflammatoire complicaties is redelijk. Vanwege het geringe aantal ‘events’ (<<300) is afgewaardeerd voor zeer ernstige onnauwkeurigheid. Dit wordt weerspiegeld in het wijde betrouwbaarheidsinterval van de NNT (6,4–276,9). Er werd niet afgewaardeerd voor publicatiebias, indirect bewijs en risk of bias*
*Overwogen is om voor risk of bias af te waarderen vanwege enige onbalans tussen interventie- en controlegroep en vanwege attrition bias. Dit is echter niet gedaan. Toelichting: gebleken is dat in de controlegroep meer vrouwen aanwezig zijn én dat vrouwen een meer dan 5x zo grote kans op een inflammatoire complicatie hebben. Dit impliceert dat de interventiegroep in ieder geval – dus los van de interventie – een kleinere kans op inflammatoire complicaties heeft. In de controlegroep namelijk zitten 121/175 = 69% vrouwen en in de interventiegroep 63%. Dit verschil lijkt te klein om voor ernstige risk of bias te zorgen. Hetzelfde geldt voor attrition bias: in de interventiegroep zijn er namelijk 10/158 uitvallers en in de controlegroep 17/175.
Conclusie
| Laag GRADE |
Inflammatoire complicaties Spoelen van de alveole met een met injectiespuit en kraanwater viermaal daags vanaf 48 uur na de ingreep tot aan het eerste bezoek 7 dagen later kan een matig effect hebben op vermindering van inflammatoire complicaties na verwijdering van de derde molaar in de onderkaak.Ghaeminia et al., 2017 |
Geldigheid
+Het Kennisinstituut Mondzorg (KIMO) is als houder van deze praktijkrichtlijn de eerstverantwoordelijke voor het actualiseren ervan. De aan deze praktijkrichtlijn deelnemende wetenschappelijke verenigingen of gebruikers ervan delen de verantwoordelijkheid en informeren de eerstverantwoordelijke over relevante ontwikkelingen binnen hun vakgebied. Deze ontwikkelingen kunnen aanleiding zijn om delen van de praktijkrichtlijn of de gehele praktijkrichtlijn te herzien voor het verlopen van de geldigheidsdatum. Uiterlijk in juni 2024 bepaalt het bestuur van het KIMO, mede op advies van de Richtlijn Advies Commissie (RAC), of deze praktijkrichtlijn nog actueel is. Als de richtlijn geheel of gedeeltelijk moet worden herzien, dan wordt daarvoor een herzieningstraject gestart, met het instellen van een ROC.
Doel
+Het doel van het project is het ontwikkelen van een up-to-date multidisciplinaire, evidence-based richtlijn voor het beleid rondom asymptomatische en symptomatische derde molaren.
Het doel van de richtlijn is duidelijkheid, en waar mogelijk en wenselijk uniformiteit, te creëren voor behandelaars van patiënten over de indicatiestelling, behandeling en nazorg rondom derde molaren.
Doelgroep
+De richtlijn beoogt een praktisch handvat te bieden aan de behandelaar van patiënten bij wie één of meer derde molaren aanwezig zijn.
Deze richtlijn is geschreven voor alle behandelaars die het al of niet verwijderen van een asymptomatische derde molaar overwegen: tandarts-algemeen practicus, MKA-chirurg, orthodontist en parodontoloog, tandarts-endodontoloog.
Initiatief
+tekst volgt
Financiering
+De richtlijnontwikkeling werd gefinancierd door stichting Kwaliteit en Scholing MKA chirurgie. De aanpassing en instroom in de KIMO-richtlijnendatabase is gefinancierd vanuit het meerjarenprogramma voor klinische praktijkrichtlijnen van het KIMO.
Samenstelling van de richtlijnontwikkelcommissie (ROC)
+Voor het ontwikkelen van de richtlijn onder verantwoordelijkheid van de Nederlandse Vereniging voor Mond-, Kaak- en Aangezichtschirurgie (NVMKA) is in 2017 een multidisciplinaire werkgroep ingesteld, bestaande uit professionals uit de mondzorg. Allen zijn betrokken bij de zorgverlening aan personen met derde molaren (zie hiervoor de samenstelling van de werkgroep).
De werkgroepleden zijn door hun beroepsverenigingen gemandateerd voor deelname. De werk-groep werkte gedurende 18 maanden aan de totstandkoming van de richtlijn.
De werkgroep is verantwoordelijk voor de integrale tekst van deze richtlijn.
- Dr. H. Ghaeminia (voorzitter), MKA-chirurg, Rijnstate ziekenhuis, Arnhem (vanaf 1-1-2018), Radboudumc, Nijmegen (tot 1-1-2018); Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- Drs. M. Burger, tandarts-algemeen practicus, ziekenhuistandarts Catharina Ziekenhuis Eindhoven, Koninklijke Nederlandse Maatschappij tot bevordering der Tandheelkunde
- Drs. M. Galjart, tandarts-algemeen practicus, Zaltbommel, Koninklijke Nederlandse Maatschappij tot bevordering der Tandheelkunde
- Dr. J.K.M. Maertens, orthodontist, Radboudumc, Nijmegen, Nederlandse Vereniging van Orthodontisten
- Drs. J.M. van der Sleen, MKA-chirurg, Isala Klinieken, Zwolle, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- Prof. dr. A. Vissink, MKA-chirurg, Universitair Medisch Centrum Groningen, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie
- Prof. dr. G.A. van der Weijden, tandarts, parodontoloog NvvP en implantoloog NVOI, Acade-misch Centrum voor Tandheelkunde Amsterdam en Paro Praktijk Utrecht & Implantologie Utrecht, Nederlandse Vereniging voor Parodontologie
Met ondersteuning van:
Dr. Ir. J.J.A. de Beer, zelfstandig richtlijnmethodoloog, Utrecht.
Voor aanpassing van de richtlijn voor instroom in de KIMO-richtlijnendatabase is in het najaar van 2019 een richtlijnontwikkelcommissie (ROC) benoemd door het KIMO, bestaande uit de volgende personen:
- Dr. H. Ghaeminia, MKA-chirurg, Rijnstate ziekenhuis, Arnhem, Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie (voorzitter ROC)
- Drs. M.K. Tuut, epidemioloog/richtlijnmethodoloog, PROVA, Varsseveld (secretaris ROC)
- Drs. M. Galjart, tandarts-algemeen practicus, Zaltbommel, Koninklijke Nederlandse Maatschappij tot bevordering der Tandheelkunde
- Drs. R.N. Vermeulen, tandarts-algemeen practicus, implantoloog NVOI, Amsterdam, namens richtlijnadviescommissie (RAC) van het KIMO
- Prof. dr. G.A. van der Weijden, tandarts, parodontoloog NvvP en implantoloog NVOI, Acade-misch Centrum voor Tandheelkunde Amsterdam en Paro Praktijk Utrecht & Implantologie Utrecht, Nederlandse Vereniging voor Parodontologie
De ROC is geadviseerd door dhr. drs. L.B.G.M. Tinsel (Zorgverzekeraars Nederland) en dr. W.E.R. Berkhout (Nederlandse Vereniging voor DentoMaxilloFaciale Radiologie).
Belangenverklaring
+De werkgroepleden hebben schriftelijk verklaard of ze in de laatste vijf jaar een (financieel ondersteunde) betrekking onderhielden met commerciële bedrijven, organisaties of instellingen die in verband staan met het onderwerp van de richtlijn. Tevens is navraag gedaan naar persoonlijke financiële belangen, belangen door persoonlijke relaties, belangen d.m.v. reputatiemanagement, belangen vanwege extern gefinancierd onderzoek, en belangen door kennisvalorisatie. De belangenverklaringen zijn op te vragen bij de Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie, een overzicht vindt u in bijlage 1. Ook van de ROC die de instroom in het KIMO-programma heeft verzorgd is een overzicht van de belangenverklaringen beschikbaar in bijlage 1.
Methode ontwikkeling
+Evidence-based.
Werkwijze onder verantwoordelijkheid NVMKA
+Deze richtlijn is opgesteld conform de eisen volgens het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II) (agreetrust.org), dat een internationaal breed geaccepteerd instrument is voor de beoordeling van de kwaliteit van richtlijnen en op de uitgave ‘Richtlijn voor richtlijnen’ (Regieraad Kwaliteit van Zorg).
Knelpuntenanalyse
+Tijdens de voorbereidende fase werden geen specifieke knelpunten geïnventariseerd. Evident is echter dat met name de volgende knelpunten breed in het veld en de wetenschappelijke verenigingen leven:
- al dan niet verwijderen van een asymptomatische derde molaar;
- al dan niet vervaardigen van een CBCT.
Uitgangsvragen en uitkomstmaten
+Tijdens de eerste vergadering werden concept-uitgangsvragen voorgesteld door de voorzitter. Door de werkgroep werden tevens aanvullende uitgangsvragen voorgesteld. Na prioritering van de vragen werden deze vastgesteld. Vervolgens inventariseerde de werkgroep per uitgangsvraag welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Deze uitkomstmaten kunnen cruciaal of minder belangrijk zijn voor de besluitvorming (Guyatt et al. (2), 2011). Zie ook de algemene inleiding en de inhoudelijke hoofdstukken.
Strategie voor zoeken en selecteren van literatuur
+Voor de afzonderlijke uitgangsvragen werd aan de hand van specifieke zoektermen gezocht naar gepubliceerde wetenschappelijke studies in (verschillende) elektronische databases (zie bijlage 2). Voor therapeutische vragen kwamen primair gerandomiseerde studies in aanmerking. Voor diagnostische accuratesse vragen kwamen primair cross-sectionele studies van opeenvolgende patiënten in aanmerking. Voor studies over risicofactoren voor postoperatieve complicaties kwamen primair prospectieve cohortstudies in aanmerking. Voor prognostische factoren voor het symptomatisch worden van asymptomatische molaren kwamen zowel prospectieve en retrospectieve cohortstudies als cross-sectionele studies in aanmerking. De werkgroepleden selecteerden de via de zoekactie gevonden artikelen op basis van vooraf opgestelde selectiecriteria (zie de paragrafen zoeken en selecteren in de verschillende hoofdstukken). De geselecteerde artikelen werden gebruikt om de uitgangsvraag te beantwoorden. De databases waarin is gezocht, de zoekactie of gebruikte trefwoorden van de zoekactie en de gehanteerde selectiecriteria zijn te vinden in het hoofdstuk van desbetreffende uitgangsvraag.
Beoordeling van de literatuur
+Individuele studies over therapie en diagnostiek werden systematisch met behulp van de GRADE-systematiek (zie bijlage 3 en bijlage 13) beoordeeld, op basis van op voorhand opgestelde methodologische kwaliteitscriteria, om zo het risico op vertekende studieresultaten (bias) te kunnen beoordelen. Voor studies over risico- of prognostische factoren biedt de GRADE Working Group nog geen ondersteuning, voor zover blijkend uit officiële publicaties hierover. Voor deze studies berustte de beoordeling vooral op het in ogenschouw nemen van de studieomvang en consistentie van de uitkomsten.
Samenvatten van de literatuur
+De relevante onderzoeksgegevens van alle geselecteerde artikelen werden overzichtelijk weergegeven in evidencetabellen (zie bijlage 4). De belangrijkste bevindingen uit de literatuur werden beschreven in de samenvatting van de literatuur.
Kennislacunes
+Tijdens de ontwikkeling van deze richtlijn is systematisch gezocht naar onderzoek waarvan de resultaten bijdragen aan een antwoord op de uitgangsvragen. Bij elke uitgangsvraag is door de werkgroep nagegaan of er (aanvullend) wetenschappelijk onderzoek gewenst is. Een overzicht van aanbevelingen voor nader/vervolg onderzoek staat in bijlage 5.
Van evidence naar aanbevelingen
+Voor het bepalen van de sterkte en richting van een aanbeveling zijn naast de kwaliteit van het wetenschappelijk bewijs over de gewenste en ongewenste effecten van een interventie de volgende aspecten van belang (Andrews et al. (1) en (2), 2013):
- Algehele kwaliteit van bewijs. De cruciale uitkomstmaat met de laagste kwaliteit van bewijs bepaalt de overall kwaliteit van bewijs,
- Waarden, voorkeuren en ervaringen van patiënten en behandelaars met betrekking tot interventies en uitkomsten van zorg,
- Kosten,
- Balans van gewenste en ongewenste effecten,
- Aanvaardbaarheid en haalbaarheid van interventies voor de stakeholders.
Bij voorkeur wordt ook voor de onder 2, 3, en 5 genoemde aspecten naar wetenschappelijk bewijs gezocht. De werkgroep die deze richtlijn heeft opgesteld, heeft behalve voor punt 2 (patiënten) hiervan afgezien omdat de hiervoor benodigde tijd in geen enkele verhouding zou staan tot de verwachte opbrengst. De werkgroep heeft, daar waar dit noodzakelijk werd geacht, op basis van eigen ervaring en expertise de hiervoor genoemde aspecten geïnventariseerd.
Bij de ontwikkeling van de richtlijn is expliciet rekening gehouden met de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, menskracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van een specifieke uitgangsvraag maken onderdeel uit van de overwegingen bij de bewuste uitgangsvraag.
Deze aspecten worden kort besproken onder het kopje ‘overwegingen’ (en voor hoofdstuk 1 uitgebreid in bijlage 6).
Formuleren van aanbevelingen
+De aanbevelingen geven een antwoord op de uitgangsvraag en zijn gebaseerd op het beste beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet bij voorbaat uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk. De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten.
Indicatorontwikkeling
+Tijdens het ontwikkelen van de conceptrichtlijn werd één structuurindicator geformuleerd. Zie bijlage 7.
Commentaar- en autorisatiefase
+De conceptrichtlijn werd aan de volgende betrokken wetenschappelijke verenigingen en beroeps-organisaties voorgelegd voor commentaar: de NVMKA, KNMT, NVvO en NVvP. Tevens werd de richtlijn voorgelegd aan de ANT, Nederlandse Vereniging voor DentoMaxilloFaciale Radiologie, Zorgverzekeraars Nederland, het College van Adviserend Tandartsen en de Patiëntenfederatie Nederland. De ANT besloot niet te participeren in de commentaarronde maar commentaar te leveren wanneer de richtlijn in een later stadium door KiMo wordt aangeboden. Van de Patiëntenfederatie Nederland werd geen commentaar ontvangen; zij zullen afstemming met het KiMo zoeken. De commentaren werden verzameld en besproken in de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijn aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijn werd aan de betrokken verenigingen (NVMKA, KNMT, NVvO en NvvP) voorgelegd voor autorisatie en door hen geautoriseerd.
Implementatie
+In de verschillende fasen van de richtlijnontwikkeling is rekening gehouden met de implementatie van de richtlijn en de praktische uitvoerbaarheid van de aanbevelingen. Daarbij is uitdrukkelijk gelet op factoren die de invoering van de richtlijn in de praktijk kunnen bevorderen of belemmeren (zie ook het implementatieplan in bijlage 8).
Werkwijze aanpassing en instroom in KIMO-richtlijnendatabase
+In overleg met de NVMKA is besloten dat het KIMO de klinische praktijkrichtlijn derde molaar in te laten stromen in het meerjarenprogramma van het KIMO. Het KIMO is daarmee eigenaar van de richtlijn en verantwoordelijk voor aanpassing en implementatie.
In de NVMKA-richtlijn was een aanbeveling opgenomen over het overwegen van een panoramische röntgenopname op de leeftijd van 17 jaar. Door Zorgverzekeraars Nederland werd aangegeven dat zij graag een wetenschappelijke onderbouwing voor deze aanbeveling zouden willen zien voordat zij deze konden accepteren. Instemming van Zorgverzekeraars Nederland is een eis van het Zorginstituut Nederland. Daarnaast was opbouw van de NVMKA-richtlijn afwijkend van het format van het KIMO en afspraken met het Zorginstituut Nederland. Bij haar beoordeling gaf de Richtlijn Autorisatie Raad van het KIMO aan dat aanpassing van de structuur de NVMKA-richtlijn nog verder zou kunnen verbeteren.
Om aan deze wensen te voldoen, is door het KIMO een nieuwe richtlijnontwikkelcommissie ingesteld. Deze commissie heeft in een tweetal vergaderingen bovenstaande discussiepunten opnieuw besproken en is tot aanpassing van de richtlijn gekomen, ook na raadpleging van twee externe experts vanuit Zorgverzekeraars Nederland en de Nederlandse Vereniging voor DentoMaxilloFaciale Radiologie. De nieuwe tekst is vervolgens ter autorisatie voorgelegd aan de Richtlijn Autorisatie Raad van het KIMO en de Nederlandse Vereniging voor Mond-, Kaak- en Aangezichtschirurgie. Na autorisatie is de richtlijn gepubliceerd in de richtlijnendatabase van het KIMO.
Patiëntenperspectief
+Door middel van een literatuursearch werd aandacht geschonken aan het patiëntenperspectief in verband met beleid rond de asymptomatische derde molaar (zie bijlage 9). Zie met name de paragraaf over overwegingen met betrekking tot verwijderen of behoud van asymptomatische derde molaar en de aanzet tot een keuzehulp in bijlage 10.
Zorgpad
+Het zorgpad behorende bij deze klinische praktijkrichtlijn, staat opgenomen in bijlage 15.
Referenties
+Abu-Mostafa NA, Alqahtani A, Abu-Hasna M, et al: A randomized clinical trial compared the effect of intra-alveolar 0.2% chloro-hexidine bio-adhesive gel versus 0.12% chlorohexidine rinse in reducing alveolar osteitis following molar teeth extractions. Med Oral Patol Oral Cir Bucal 20:e82, 2015
Agbaje JO, Heijsters G, Salem AS, Van Slycke S, Schepers S, Politis C, Vrielinck L. Coronectomy of Deeply Impacted Lower Third Molar: Incidence of Outcomes and Complications after One Year Follow-Up. J Oral Maxillofac Res. 2015 Jun 30;6(2):e1.
Al-Asfour A. Postoperative infection after surgical removal of impacted mandibular third molars: an analysis of 110 consecutive procedures. Med Princ Pract. 2009;18(1):48-52.
Allen RT, Witherow H, Collyer J, Roper-Hall R, Nazir MA, Mathew G. The mesioangular third molar–to extract or not to extract? Analysis of 776 consecutive third molars. Br Dent J. 2009 Jun 13;206(11):E23
Andrews J (1), Guyatt G, Oxman AD, Alderson P, Dahm P, Falck-Ytter Y, Nasser M, Meerpohl J, Post PN, Kunz R, Brozek J, Vist G, Rind D, Akl EA, Schünemann HJ. GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations. J Clin Epidemiol. 2013 Jul;66(7):719-25.
Andrews JC (2), Schünemann HJ, Oxman AD, Pottie K, Meerpohl JJ, Coello PA, Rind D, Montori VM, Brito JP, Norris S, Elbarbary M, Post P, Nasser M, Shukla V, Jaeschke R, Brozek J, Djulbegovic B, Guyatt G. GRADE guidelines: 15. Going from evidence to recommendation-determinants of a recommendation’s direction and strength. J Clin Epidemiol. 2013 Jul;66(7):726-35.
Anjrini AA, Kruger E, Tennant M. Cost effectiveness modelling of a ‘watchful monitoring strategy’ for impacted third molars vs prophylactic removal under GA: an Australian perspective. Br Dent J. 2015 Jul 10;219(1):19-23.
Arteagoitia I, Diez A, Barbier L, Santamaria G, Santamaria J. Efficacy of amoxicillin/clavulanic acid in preventing infectious and inflammatory complications following impacted mandibular third molar extraction. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology 2005;100(1):e11–8.
Babar A, Ibrahim MW, Baig NJ, et al: Effcacy of intra-alveolar chlorhexidine gel in reducing frequency of alveolar osteitis in mandibular third molar surgery. J Coll Physicians Surg Pak 22: 91, 2012
Balshem H, Helfand M, Schünemann HJ, Oxman AD, Kunz R, Brozek J, Vist GE, Falck-Ytter Y, Meerpohl J, Norris S, Guyatt GH. GRADE guidelines: 3. Rating the quality of evidence. J Clin Epidemiol. 2011 Apr;64(4):401-6.
Baqain ZH, Al-Shafii A, Hamdan AA, Sawair FA. Flap design and mandibular third molar surgery: A split mouth randomized clinical study. International Journal of Oral and Maxillofacial Surgery 2012; Vol. 41, issue 8:1020–4.
Baqain ZH, Karaky AA, Sawair F, Khraisat A, Duaibis R, Rajab LD. Frequency estimates and risk factors for postoperative morbidity after third molar removal: a prospective cohort study. J Oral Maxillofac Surg. 2008 Nov;66(11):2276-83.
Barclay JK. Metronidazole and dry socket: prophylactic use in mandibular third molar removal complicated by nonacute peri-coronitis. New Zealand Dental Journal 1987;83: 71–5.
Barone A, Marconcini S, Giacomelli L, Rispoli L, Calvo JL, Covani U. A randomized clinical evaluation of ultrasound bone surgery versus traditional rotary instruments in lower third molar extraction. Journal of Oral and Maxillofacial Surgery 2010; Vol. 68, issue 2:330–6.
Bastos Carmo A do, de Oliveira JB, Mello KF, Leão PB, Artese F, Normando D. The ability of orthodontists and oral/maxillofacial surgeons to predict eruption of lower third molar. Prog Orthod. 2016 Dec;17(1):21.
Bello SA, Olaitan AA, Ladeinde AL. A randomized comparison of the effect of partial and total wound closure techniques on postoperative morbidity after mandibular third molar surgery. Journal of Oral and Maxillofacial Surgery 2011;69:e24–30.
Benediktsdóttir IS, Wenzel A, Petersen JK, Hintze H. Mandibular third molar removal: risk indicators for extended operation time, postoperative pain, and complications. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2004 Apr;97(4):438-46.
Bergdahl M, Hedstrom L. Metronidazole for the prevention of dry socket after removal of partially impacted mandibularthird molar: a randomised controlled trial. British Journal of Oral & Maxillofacial Surgery 2004;42(6):555–8.
Berwick JE, Lessin ME: Effects of a chlorhexidine gluconate oral rinse on the incidence of alveolar osteitis in mandibular third molar surgery. J Oral Maxillofac Surg 48:444, 1990
Bienstock DA, Dodson TB, Perrott DH, Chuang SK. Prognostic factors affecting the duration of disability after third molar removal. J Oral Maxillofac Surg. 2011 May;69(5):1272-7.
Blakey GH, Marciani RD, Haug RH, Phillips C, Offenbacher S, Pabla T, White RP Jr. Periodontal pathology associated with asymptomatic third molars. J Oral Maxillofac Surg. 2002 Nov;60(11):1227-33.
Blondeau F, Daniel NG. Extraction of impacted mandibular third molars: postoperative complications and their risk factors. J Can Dent Assoc. 2007 May;73(4):325.
Bortoluzzi MC, Capella DL, Barbieri T, et al: A single dose of amoxicillin and dexamethasone for prevention of postoperative complications in third molar surgery: A randomized, doubleblind, placebo controlled clinical trial. J Clin Med Res 5:26, 2013.
Briguglio F, Zenobio EG, Isola G, Briguglio R, Briguglio E, Farronato D, et al. Complications in surgical removal of impacted mandibular third molars in relation to flap design: clinical and statistical evaluations. Quintessence International 2011; Vol. 42, issue 6:445–53.
Butler DP, Sweet JB. Effect of lavage on the incidence of localized osteitis in mandibular third molar extraction sites. Oral Surgery 1977;44(1):14–20.
Bystedt H, von Konow L, Nord CE. A comparison of the effect of phenoxymethylpenicillin and azidocillin on postoperative complications after surgical removal of impacted mandibular third molars. Swedish Dental Journal 1981;5(5-6):225–34.
Carter K, Worthington S. Predictors of third molar impaction: a systematic review and meta-analysis. J Dent Res 2016; 95: 267-76.
Cerqueira PR, Vasconcelos BC, Bessa-Nogueira RV. Comparative study of the effect of a tube drain in impacted lower third molar surgery. Journal of Oral and Maxillofacial Surgery 2004;62(1):57–61.
Chang SW, Shin SY, Kum KY, Hong J. Correlation study between distal caries in the mandibular second molar and the eruption status of the mandibular third molar in the Korean population. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2009 Dec;108(6):838-43.
Cheung LK, Leung YY, Chow LK, Wong MC, Chan EK, Fok YH. Incidence of neurosensory deficits and recovery after lower third molar surgery: a prospective clinical study of 4338 cases. Int J Oral Maxillofac Surg. 2010 Apr;39(4):320-6.
Chu FC, Li TK, Lui VK, Newsome PR, Chow RL, Cheung LK. Prevalence of impacted teeth and associated pathologies–a radio-graphic study of the Hong Kong Chinese population. Hong Kong Med J. 2003 Jun;9(3):158-63.
Chuang SK, Perrott DH, Susarla SM, Dodson TB. Age as a risk factor for third molar surgery complications. J Oral Maxillofac Surg. 2007 Sep;65(9):1685-92.
Chukwuneke FN, Oji C, Saheeb DB. A comparative study of the effect of using a rubber drain on postoperative discomfort following lower third molar surgery. International Journal of Oral and Maxillofacial Surgery 2008; 37(4):341–4.
Clé-Ovejero A, Sánchez-Torres A, Camps-Font O, Gay-Escoda C, Figueiredo R, Valmaseda-Castellón E. Does 3-dimensional imaging of the third molar reduce the risk of experiencing inferior alveolar nerve injury owing to extraction?: A meta-analysis. J Am Dent Assoc. 2017 Aug;148(8):575-583.
Danda AK, Krishna Tatiparthi M, Narayanan V, Siddareddi A. Influence of primary and secondary closure of surgical wound after impacted mandibular third molar removal on postoperative pain and swelling–a comparative and split mouth study. Journal of Oral and Maxillofacial Surgery 2010;68(2):309–12.
de Brabander EC, Cattaneo G. The effect of surgical drain together with a secondary closure technique on postoperative tris-mus, swelling and pain after mandibular third molar surgery. International Journal of Oral and Maxillofacial Surgery 1998;17(2):119–21.
Delilbasi C, Saracoglu SH, Kesken A: Effects of 0.2% chlorhexidine gluconate and amoxicillin plus clavulanic acid on the preven-tion of alveolar osteitis following mandibular third molar extractions. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 94:301, 2002
Divaris K, Fisher EL, Shugars DA, White RP Jr. Risk factors for third molar occlusal caries: a longitudinal clinical investigation. J Oral Maxillofac Surg. 2012 Aug;70(8):1771-80.
Doğan N, Orhan K, Günaydin Y, Köymen R, Okçu K, Uçok O. Unerupted mandibular third molars: symptoms, associated pathologies, and indications for removal in a Turkish population. Quintessence Int. 2007 Sep;38(8):e497-505.
Dolanmaz D, Yildirim G, Isik K, Kucuk K, Ozturk A. A preferable technique for protecting the inferior alveolar nerve: coronectomy. J Oral Maxillofac Surg. 2009;67:1234-8.
Elter JR, Offenbacher S, White RP, Beck JD. Third molars associated with periodontal pathology in older Americans. J Oral Maxillofac Surg. 2005 Feb;63(2):179-84.
Erdogan O, Tatli U, Ustun Y, Damlar I. Influence of two different flap designs on the sequelae of mandibular third molar surgery. Oral and Maxillofacial Surgery 2011;15(3): 147–52.
Falci SG, de Castro CR, Santos RC, de Souza Lima LD, Ramos-Jorge ML, Botelho AM, Dos Santos CR. Association between the presence of a partially erupted mandibular third molar and the existence of caries in the distal of the second molars. Int J Oral Maxillofac Surg. 2012 Oct;41(10):1270-4.
Fisher EL, Garaas R, Blakey GH, Offenbacher S, Shugars DA, Phillips C, White RP Jr. Changes over time in the prevalence of caries experience or periodontal pathology on third molars in young adults. J Oral Maxillofac Surg. 2012 May;70(5):1016-22.
Freudenthal N, Sternudd M, Jansson L, et al: A double-blind randomized study evaluating the effect of intra-alveolar chlorhexi-dine gel on alveolar osteitis after removal of mandibular third molars. J Oral Maxillofac Surg 73:600, 2015
Garaas RN, Fisher EL, Wilson GH, Phillips C, Shugars DA, Blakey GH, Marciani RD, White RP Jr. Prevalence of third molars with caries experience or periodontal pathology in young adults. J Oral Maxillofac Surg. 2012 Mar;70(3):507-13.
Gargallo-Albiol J, Buenechea-Imaz R, Gay-Escoda C. Lingual nerve protection during surgical removal of lower third molars. A prospective randomised study. International Journal Oral and Maxillofacial Surgery 2000;29(4):268–71.
Ghaeminia H, Gerlach NL, Hoppenreijs TJ, Kicken M, Dings JP, Borstlap WA, de Haan T, Bergé SJ, Meijer GJ, Maal TJ. Clinical relevance of cone beam computed tomography in mandibular third molar removal: A multicentre, randomised, controlled trial. J Craniomaxillofac Surg. 2015 Dec;43(10):2158-67.
Ghaeminia H, Hoppenreijs TJ, Xi T, Fennis JP, Maal TJ, Bergé SJ, Meijer GJ. Postoperative socket irrigation with drinking tap water reduces the risk of inflammatory complications following surgical removal of third molars: a multicenter randomized trial. Clin Oral Investig. 2017 Jan;21(1):71-83
Ghaeminia H, Meijer GJ, Soehardi A, Borstlap WA, Mulder J, Bergé SJ. Position of the impacted third molar in relation to the mandibular canal. Diagnostic accuracy of cone beam computed tomography compared with panoramic radiography. Int J Oral Maxillofac Surg. 2009 Sep;38(9):964-71.
Ghaeminia H, Perry J, Nienhuijs MEL, Toedtling V, Tummers M, Hoppenreijs TJM, Van der Sanden WJM, Mettes TG. Surgical removal versus retention for the management of asymptomatic disease-free impacted wisdom teeth. Cochrane Database of Systematic Reviews 2016, Issue 8. Art. No.: CD003879.
Goldsmith SM, De Silva RK, Tong DC, Love RM. Influence of a pedicle flap design on acute postoperative sequelae after lower third molar removal. International Journal of Oral and Maxillofacial Surgery 2012;41(3):371–5.
Gomes ACA, Vasconcelos BC, de Oliveira e Silva ED, da Silva LC. Lingual nerve damage after mandibular third molar surgery: a randomised clinical trial. Journal of Oral and Maxillofacial Surgery 2005;63(10):1443–6.
Goto S, Kurita K, Kuroiwa Y, Hatano Y, Kohara K, Izumi M, et al. Clinical and dental computed tomographic evaluation 1 year after coronectomy. J Oral Maxillofac Surg. 2012;70:1023–9.
Greenwood M, Langton SG, Rood JP. A comparison of broad and narrow retractors for lingual nerve protection during lower third molar surgery. British Journal of Oral and Maxillofacial Surgery 1994;32(2):114–7.
Grossi GB, Maiorana C, Garramone RA, Borgonovo A, Creminelli L, Santoro F. Assessing postoperative discomfort after third molar surgery: a prospective study. J Oral Maxillofac Surg. 2007 May;65(5):901-17.
Guerrero ME, Botetano R, Beltran J, Horner K, Jacobs R. Can preoperative imaging help to predict postoperative outcome after wisdom tooth removal? A randomized controlled trial using panoramic radiography versus cone-beam CT. Clin Oral Investig. 2014 Jan;18(1):335-42.
Güven O, Keskin A, Akal UK. The incidence of cysts and tumors around impacted third molars. Int J Oral Maxillofac Surg. 2000 Apr;29(2):131-5.
Guyatt G (1), Oxman AD, Akl EA, Kunz R, Vist G, Brozek J, Norris S, Falck-Ytter Y, Glasziou P, De Beer H, Jaeschke R, Rind D, Meerpohl J, Dahm P, Schünemann HJ. GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables. J Clin Epidemiol. 2011 Apr;64(4):383-94.
Guyatt GH (2), Oxman AD, Kunz R, Atkins D, Brozek J, Vist G, Alderson P, Glasziou P, Falck-Ytter Y, Schünemann HJ. GRADE guidelines: 2. Framing the question and deciding on important outcomes. J Clin Epidemiol. 2011 Apr;64(4):395-400.
Halpern LR, Dodson TB. Does prophylactic administration of systemic antibiotics prevent postoperative inflammatory complica-tions after third molar surgery?. Journal of Oral and Maxillofacial Surgery 2007;65(2):177–85.
Hanna K, Sambrook P, Armfield JM, Brennan DS. Preferences for dental decisional control and associations with quality of life among third molar patients attending public dental services. Community Dent Health. 2017 Sep;34(3):163-168.
Happonen RP, Backstrom AC, Ylipaavalniemi P. Prophylactic use of phenoxymethylpenicillin and tinidazole in mandibular third molar surgery, a comparative placebo controlled clinical trial. British Journal of Oral & Maxillofacial Surgery 1990;28(1):12–5.
Harada N, Beloor Vasudeva S, Matsuda Y, Seki K, Kapila R, Ishikawa N, Okano T, Sano T. Characteristic findings on panoramic radiography and cone-beam CT to predict paresthesia after extraction of impacted third molar. Bull Tokyo Dent Coll. 2015;56(1):1-8.
Haraji A, Motamedi MH, Rezvani F. Can flap design influence the incidence of alveolar osteitis following removal of impacted mandibular third molars?. General Dentistry 2010; Vol. 58, issue 5:e187–9.
Haraji A, Rakhshan V, Khamverdi N, et al: Effects of intra-alveolar placement of 0.2% chlorhexidine bioadhesive gel on dry socket incidence and postsurgical pain: A double-blind split-mouth randomized controlled clinical trial. J Orofac Pain 27:256, 2013
Harradine NW, Pearson MH, Toth B. The effect of extraction of third molars on late lower incisor crowding: a randomized controlled trial. British Journal of Orthodontics 1998;25(2):117–22.
Hasani A, Ahmadi Moshtaghin F, Roohi P, Rakhshan V. Diagnostic value of cone beam computed tomography and panoramic radiography in predicting mandibular nerve exposure during third molar surgery. Int J Oral Maxillofac Surg. 2016 Oct 31. pii: S0901-5027(16)30276-4.
Hasegawa T, Ri S, Shigeta T, Akashi M, Imai Y, Kakei Y, Shibuya Y, Komori T. Risk factors associated with inferior alveolar nerve injury after extraction of the mandibular third molar–a comparative study of preoperative images by panoramic radiography and computed tomography. Int J Oral Maxillofac Surg. 2013 Jul;42(7):843-51.
Hasegawa T, Ri S, Umeda M, Komori T. Multivariate relationships among risk factors and hypoesthesia of the lower lip after extraction of the mandibular third molar. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2011 Jun;111(6):e1-7.
Hasegawa Y, Terada K, Kageyama I, Tsuchimochi T, Ishikawa F, Nakahara S. Influence of third molar space on angulation and dental arch crowding. Odontology. 2013 Jan;101(1):22-8.
Hashemi HM, Beshkar M, Aghajani R. The effect of sutureless wound closure on postoperative pain and swelling after impacted mandibular third molar surgery. British Journal of Oral and Maxillofacial Surgery 2012;50(3):256–8.
Haug RH, Perrott DH, Gonzalez ML, Talwar RM. The American Association of Oral and Maxillofacial Surgeons Age-Related Third Molar Study. J Oral Maxillofac Surg. 2005 Aug;63(8):1106-14.
Hazza’a AM(1), Bataineh AB, Odat AA. Angulation of mandibular third molars as a predictive factor for pericoronitis. J Contemp Dent Pract. 2009 May 1;10(3):51-8.
Hermesch CB, Hilton TJ, Biesbrock AR, et al: Perioperative use of 0.12% chlorhexidine gluconate for the prevention of alveolar osteitis: Efficacy and risk factor analysis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 85:381, 1998
Hita-Iglesias P, Torres-Lagares D, Flores-Ruiz R, et al: Effectiveness of chlorhexidine gel versus chlorhexidine rinse in reducing alveolar osteitis in mandibular third molar surgery. J Oral Maxillofac Surg 66:441, 2008
Huang GJ, Cunha-Cruz J, Rothen M, Spiekerman C, Drangsholt M, Anderson L, Roset GA. A prospective study of clinical outcomes related to third molar removal or retention. Am J Public Health. 2014 Apr;104(4):728-34.
Kaczmarzyk T, Wichlinski J, Stypulkowska J, Zaleska M, Panas M, Woron J. Single-dose and multi-dose clindamycin therapy fails to demonstrate efficacy in preventing infectious and inflammatory complications in third molar surgery. International Journal of Oral and Maxillofacial Surgery 2007; 36(5):417–22.
Kang F, Huang C, Sah MK, Jiang B. Effect of Eruption Status of the Mandibular Third Molar on Distal Caries in the Adjacent Sec-ond Molar. J Oral Maxillofac Surg. 2016 Apr;74(4):684-92.
Kirk DG, Liston PN, Tong DC, Love RM. Influence of two different flap designs on incidence of pain, swelling, trismus, and alveolar osteitis in the week following third molar surgery. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontics 2007;104(1):e1–6.
Kouwenberg AJ, Stroy LP, Rijt ED, Mensink G, Gooris PJ. Coronectomy of the mandibular third molar: Respect for the inferior alveolar nerve. J Craniomaxillofac Surg. 2016 May;44(5):616-21.
Krekmanov L, Hallander HO. Relationship between bacterial contamination and alveolitis after third molar surgery. International Journal of Oral Surgery 1980;9(4): 274–80.
Krekmanov L, Nordenram A: Postoperative complications after surgical removal of mandibular third molars. Effects of penicillin V and chlorhexidine. Int J Oral Maxillofac Surg 15:25, 1986
Krekmanov L. Alveolitis after operative removal of third molars in the mandible. International Journal of Oral Surgery 1981;10(3):173–9.
Kugelberg CF, Ahlström U, Ericson S, Hugoson A, Thilander H. The influence of anatomical, pathophysiological and other factors on periodontal healing after impacted lower third molar surgery. A multiple regression analysis. J Clin Periodontol. 1991 Jan;18(1):37-43.
Lacasa JM, Jiménez JA, Ferrás V, Bossom M, Sóla-Morales O, García-Rey C, et al.Prophylaxis versus pre-emptive treatment for infective and inflammatory complications of surgical third molar removal: a randomized, double-blind, placebo-controlled, clinical trial with sustained release amoxicillin/clavulanic acid (1000/62.5 mg). International Journal of Oral and Maxillofacial Surgery 2007;36(4):321–7.
Larsen PE: Use of chlorhexidine to prevent alveolar osteitis. J Oral Maxillofac Surg 48:1244, 1990
Leon Arcila ME, Acosta P, Bravo BE, Mena A, Noguera DP, Zúñiga JR. Antibiotic prophylaxis in third molar surgery [Profilaxis antibiotica en cirugia de terceros molars incluidos]. Revista Estomatologia 2001; Vol. 9, issue 2: 4–13.
Leung YY, Cheung LK. Coronectomy of the lower third molar is safe within the first 3 years. J Oral Maxillofac Surg. 2012;70:1515–22.
Leung YY, Cheung LK. Long-term morbidities of coronectomy on lower third molar. Oral Surg Oral Med Oral Pathol Oral Radiol. 2016 Jan;121(1):5-11.
Leung YY, Cheung LK. Safety of coronectomy versus excision of wisdom teeth: a randomized controlled trial. Oral Surgery Oral Medicine Oral Pathology Oral Radiology. Endodontics 2009; Vol. 108, issue 6:821–7.
Leung YY, McGrath C, Cheung LK. Trigeminal neurosensory deficit and patient reported outcome measures: the effect on quality of life. PLoS One. 2013 Oct 29;8(10):e77391.
Li ZB, Qu HL, Zhou LN, Tian BM, Chen FM. Influence of Non-Impacted Third Molars on Pathologies of Adjacent Second Molars: A Retrospective Study. J Periodontol. 2017 May;88(5):450-456.
Liedholm R, Knutsson K, Lysell L, Rohlin M, Brickley M, Shepherd JP. The outcomes of mandibular third molar removal and non-removal: a study of patients’ preferences using a multi-attribute method. Acta Odontol Scand. 2000 Dec;58(6):293-8.
Liedholm R, Knutsson K, Lysell L, Rohlin M, Brickley M, Shepherd J. Third molar treatment outcome: a comparison of patients’ preferences in Sweden and Wales. Br Dent J. 2005 Sep 10;199(5):287-91.
Liversidge HM, Marsden PH. Estimating age and the likelihood of having attained 18 years of age using mandibular third molars. Br Dent J. 2010 Oct 23;209(8):E13.
Lodi G, Figini L, Sardella A, Carrassi A, Del Fabbro M, Furness S. Antibiotics to prevent complications following tooth extractions. Cochrane Database of Systematic Reviews 2012, Issue 11. Art.No.:CD003811.
López-Cedrún JL, Pijoan JI, Fernández S, Santamaria J, Hernandez G. Efficacy of amoxicillin treatment in preventing postoperative complications in patients undergoing third molar surgery: a prospective, randomized, double-blind controlled study. Journal of Oral and Maxillofacial Surgery 2011;69:e5–e14.
Ludlow, J.B., et al., Effective dose of dental CBCT-a meta analysis of published data and additional data for nine CBCT units. Dentomaxillofac Radiol, 2015. 44(1): p. 20140197.
Ludlow, J.B., L.E. Davies-Ludlow, and S.C. White, Patient risk related to common dental radiographic examinations: the impact of 2007 International Commission on Radiological Protection recommendations regarding dose calculation. J Am Dent Assoc, 2008. 139(9): p. 1237-43.
Malkawi Z, Al-Omiri MK, Khraisat A. Risk indicators of postoperative complications following surgical extraction of lower third molars. Med Princ Pract. 2011;20(4):321-5.
Marcussen KB, Laulund AS, Jørgensen HL, Pinholt EM. A Systematic Review on Effect of Single-Dose Preoperative Antibiotics at Surgical Osteotomy Extraction of Lower Third Molars. J Oral Maxillofac Surg. 2016 Apr;74(4):693-703.
Monaco G, Tavernese L, Agostini R, Marchetti C. Evaluation of antibiotic prophylaxis in reducing postoperative infection after mandibular third molar extraction in young patients. Journal of Oral and Maxillofacial Surgery 2009;67(7):1467–72.
Matzen LH, Christensen J, Hintze H, Schou S, Wenzel A. Diagnostic accuracy of panoramic radiography, stereo-scanography and cone beam CT for assessment of mandibular third molars before surgery. Acta Odontol Scand. 2013 Nov;71(6):1391-8.
Matzen LH, Hintze H, Spin-Neto R, Wenzel A. Reproducibility of mandibular third molar assessment comparing two cone beam CT units in a matched pairs design. Dentomaxillofac Radiol. 2013b;42(10):20130228.
Matzen LH, Schropp L, Spin-Neto R, Wenzel A. Use of cone beam computed tomography to assess significant imaging findings related to mandibular third molar impaction. Oral Surg Oral Med Oral Pathol Oral Radiol. 2017 Aug 2. pii: S2212-4403(17)31010-6.
Matzen LH, Wenzel A. Efficacy of CBCT for assessment of impacted mandibular third molars: a review – based on a hierarchical model of evidence. Dentomaxillofac Radiol. 2015;44(1):20140189.
McArdle LW, Renton TF. Distal cervical caries in the Mandibular second molar: An indication for the prophylactic removal of the third molar? Br J Oral Maxillofac Surg 2005;44:42–5.
Metin M, Tek M, Sener I: Comparison of two chlorhexidine rinse protocols on the incidence of alveolar osteitis following the surgical removal of impacted third molars. JContempDent Pract 7:79, 2006
Mocan A, Kisnisci R, Ucok C. Stereophotogrammetric and clinical evaluation of morbidity after removal of lower third molars by two different surgical techniques. Journal of Oral and Maxillofacial Surgery 1996;54(2):171–5.
Monaco G, de Santis G, Gatto MR, Corinaldesi G, Marchetti C. Coronectomy: a surgical option for impacted third molars in close proximity to the inferior alveolar nerve. J Am Dent Assoc. 2012;143:363–9.
Monaco G, De Santis G, Pulpito G, Gatto MR, Vignudelli E, Marchetti C. What Are the Types and Frequencies of Complications Associated With Mandibular Third Molar Coronectomy? A Follow-Up Study. J Oral Maxillofac Surg. 2015 Jul;73(7):1246-53.
Mukherjee S, Vikraman B, Sankar D, Veerabahu MS. Evaluation of Outcome Following Coronectomy for the Management of Mandibular Third Molars in Close Proximity to Inferior Alveolar Nerve. J Clin Diagn Res. 2016 Aug;10(8):ZC57-62.
Nageshwar N. Comma incision for impacted mandibular third molars. Journal of Oral andMaxillofacial Surgery 2002; 60(12):1506–9.
Naichuan Su et al. Predictive Value of Panoramic Radiography for Injury of Inferior Alveolar Nerve After Mandibular Third Molar Surgery. J Oral Maxillofac Surg -:1-17, 2016 (in press).
Nemcovsky CE, Libfeld H, Zubery Y. Effect of non-erupted 3rd molars on distal roots and supporting structures of approximal teeth. A radiographic survey of 202 cases. J Clin Periodontol. 1996 Sep;23(9):810-5.
Nunn ME, Fish MD, Garcia RI, Kaye EK, Figueroa R, Gohel A, Ito M, Lee HJ, Williams DE, Miyamoto T. Retained asymptomatic third molars and risk for second molar pathology. J Dent Res. 2013 Dec;92(12):1095-9. doi: 10.1177/0022034513509281. Epub 2013 Oct 16.
Oenning AC, Melo SL, Groppo FC, Haiter-Neto F. Mesial inclination of impacted third molars and its propensity to stimulate external root resorption in second molars–a cone-beam computed tomographic evaluation. J Oral Maxillofac Surg. 2015 Mar;73(3):379-86.
Osunde OD, Adebola RA, Saheeb BD. A comparative study of the effect of suture-less and multiple suture techniques on inflammatory complications following third molar surgery. International Journal of Oral and Maxillofacial Surgery 2012; Vol. 41, issue 10:1275–9.
Osunde OD, Saheeb BD, Adebola RA. Comparative study of effect of single and multiple suture techniques on inflammatory complications after third molar surgery. Journal of Oral and Maxillofacial Surgery 2011;69:971–6.
Ozeç I, Hergüner Siso S, Taşdemir U, Ezirganli S, Göktolga G. Prevalence and factors affecting the formation of second molar distal caries in a Turkish population. Int J Oral Maxillofac Surg. 2009 Dec;38(12):1279-82.
Padhye MN, Dabir AV, Girotra CS, Pandhi VH. Pattern of mandibular third molar impaction in the Indian population: a retrospective clinico-radiographic survey. Oral Surg Oral Med Oral Pathol Oral Radiol. 2013 Sep;116(3):e161-6.
Pasqualini D, Cocero N, Castella A, Mela L, Bracco P. Primary and secondary closure of the surgical wound after removal of impacted mandibular third molars: a comparative study. International Journal of Oral and Maxillofacial Surgery 2005;34(1):52–7.
Pasupathy S, Alexander M. Antibiotic prophylaxis in third molar surgery. Journal of Craniofacial Surgery 2011;22: 551–3.
Petersen LB, Olsen KR, Christensen J, Wenzel A. Image and surgery-related costs comparing cone beam CT and panoramic imaging before removal of impacted mandibular third molars. Dentomaxillofac Radiol. 2014;43(6):20140001.
Petersen LB, Vaeth M, Wenzel A. Neurosensoric disturbances after surgical removal of the mandibular third molar based on either panoramic imaging or cone beam CT scanning: A randomized controlled trial (RCT). Dentomaxillofac Radiol. 2016;45(2):20150224.
Pogrel MA, Lee JS, Muff DF. Coronectomy: a technique to protect the inferior alveolar nerve. J Oral Maxillofac Surg. 2004;62:1447–52.
Polat HB, Ozan F, Kara I, Ozdemir H, Ay S. Prevalence of commonly found pathoses associated with mandibular impacted third molars based on panoramic radiographs in Turkish population. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008 Jun;105(6):e41-7.
Praveen G, Rajesh P, Neelakandan RS, Nandagopal CM. Comparison of morbidity following the removal of mandibular third molar by lingual split, surgical bur and simplified split bone technique. Indian Journal of Dental Research 2007;18(1):15–8.
Ragno JR Jr, Szkutnik AJ: Evaluation of 0.12% chlorhexidine rinse on the prevention of alveolar osteitis. Oral Surg Oral Med Oral Pathol 72:524, 1991
Rakprasitkul S, Pairuchvej V. Mandibular third molar surgery with primary closure with a drain. International Journal of Oral and Maxillofacial Surgery 1997;26(3): 187–90.
Refo’a Y, Ouatik N, Golchin F, Mahboobi N. Comparing primary and secondary wound healing discomfort after mandibular third molar surgery: a randomized, double blind clinical trial. General Dentistry 2011; Vol. 59, issue 4:310–3.
Renton T, Hankins M, Sproate C, McGurk M. A randomised controlled clinical trial to compare the incidence of injury to the inferior alveolar nerve as a result of coronectomy and removal of mandibular third molars. British Journal of Oral and Maxillofacial Surgery 2005;43(1): 7–12.
Ritzau M, Hillerup S, Branebjerg PE, Ersbol BK. Does metronidazole prevent alveolitis sicca dolorosa? A doubleblind, placebo-controlled clinical study. International Journal of Oral and Maxillofacial Surgery 1992;21(5): 299–302.
Rodríguez Sánchez F, Rodríguez Andrés C, Arteagoitia Calvo I. Does Chlorhexidine Prevent Alveolar Osteitis After Third Molar Extractions? Systematic Review and Meta-Analysis. J Oral Maxillofac Surg. 2017 Jan 13. pii:S0278-2391(17)30020-4. doi: 10.1016/j.joms.2017.01.002
Rodrıguez-Perez M, Bravo-Perez M, Sanchez-Lopez JD, et al: Effectiveness of 1% versus 0.2% chlorhexidine gels in reducing alveolar osteitis from mandibular third molar surgery: A randomized, double-blind clinical trial. Med Oral Patol Oral Cir Bucal 18: e693, 2013
Roode GJ, Butow K. An alternative surgical flap design for impacted third molars: a comparison of two different surgical tech-niques. SADJ 2010;65(6):246, 248-51.
Rubio-Palau J, Garcia-Linares J, Hueto-Madrid JA, et al: Effect of intra-alveolar placement of 0.2% chlorhexidine bioadhesive gel on the incidence of alveolar osteitis following the extraction of mandibular third molars. A double-blind randomized clinical trial. Med Oral Patol Oral Cir Bucal 20:e117, 2015
Rullo R, Addabbo F, Papaccio G, D’Aquino R, Festa VM. Piezoelectric device vs. conventional rotative instruments in impacted third molar surgery: relationships between surgical difficulty and postoperative pain with histological evaluations. Journal of Cranio-Maxillo-Facial Surgery 2013; 41(2):e33–8. [PUBMED: 22890087]
Saglam AA. Effects of tube drain with primary closure techniques on postoperative trismus and swelling after removal of fully impacted mandibular third molars. Quintessence International 2003;34(2):143–7.
Sandhu A, Sandhu S, Kaur T. Comparison of two different flap designs in the surgical removal of bilateral impacted mandibular third molars. International Journal of Oral and Maxillofacial Surgery 2010;39(11):1091–6.
Sekhar CH, Narayanan V, Baig MF. Role of antimicrobials in third molar surgery: prospective, double blind, randomized, placebo-controlled clinical study. British Journal of Oral & Maxillofacial Surgery 2001; Vol. 39, issue 2:134–7. Absi EG, Shepherd JP. A comparison of morbidity following the removal of lower third molars by lingual split and surgical bur methods. International Journal of Oral and Maxillofacial Surgery 1993;22(3):149–53.
Shin SM, Choi EJ, Moon SY. Prevalence of pathologies related to impacted mandibular third molars. Springerplus. 2016 Jun 29;5(1):915.
Shiratori K, Nakamori K, Ueda M, Sonoda T, Dehari H. Assessment of the shape of the inferior alveolar canal as a marker for increased risk of injury to the inferior alveolar nerve at third molar surgery: a prospective study. J Oral Maxillofac Surg. 2013 Dec;71(12):2012-9.
Shugars DA, Elter JR, Jacks MT, White RP, Phillips C, Haug RH, Blakey GH. Incidence of occlusal dental caries in asymptomatic third molars. J Oral Maxillofac Surg. 2005 Mar;63(3):341-6.
Srinivas DR. Effect of Surgical Tube Drain with Primary Closure Technique after Removal of Impacted Mandibular Third Molars – a Clinical Study (Dissertation). Kamataka, Bangalore: Rajiv Gandhi University of Health Sciences. Karnataka, Bangalore, India: Rajiv Gandhi University of Health Sciences, 2006:1–51.
Srivastava N, Shetty A, Goswami RD, Apparaju V, Bagga V, Kale S. Incidence of distal caries in mandibular second molars due to impacted third molars: Nonintervention strategy of asymptomatic third molars causes harm? A retrospective study. Int J Appl Basic Med Res. 2017 Jan-Mar;7(1):15-19.
Stathopoulos P, Mezitis M, Kappatos C, Titsinides S, Stylogianni E. Cysts and tumors associated with impacted third molars: is prophylactic removal justified? J Oral Maxillofac Surg. 2011 Feb;69(2):405-8.
Sweet JB, Butler MS, Drager JL. Effects of lavage techniques with third molar surgery. Oral Surgery, Oral Medicine, and Oral Pathology 1976;41(2):152–68.
Tantanapornkul W, Okouchi K, Fujiwara Y, Yamashiro M, Maruoka Y, Ohbayashi N, Kurabayashi T. A comparative study of cone-beam computed tomography and conventional panoramic radiography in assessing the topographic relationship between the mandibular canal and impacted third molars. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007 Feb;103(2):253-9.
Tjernberg A: Influence of oral hygiene measures on the development of alveolitis sicca dolorosa after surgical removal of mandibular third molars. Int J Oral Surg 8:430, 1979
Toedtling V, Coulthard P, Thackray G. Distal caries of the second molar in the presence of a mandibular third molar – a prevention protocol. Br Dent J. 2016 Sep 23;221(6):297-302.
Torres-Lagares D, Gutierrez-Perez JL, Infante-Cossio P, et al: Randomized, double-blind study on effectiveness of intra-alveolar chlorhexidine gel in reducing the incidence of alveolar osteitis in mandibular third molar surgery. Int J Oral Maxillofac Surg 35:348, 2006
Ventä I, Kylätie E, Hiltunen K. Pathology related to third molars in the elderly persons. Clin Oral Investig. 2015 Nov;19(8):1785-9.
Ventä I, Meurman JH, Murtomaa H, Turtola L. Effect of erupting third molars on dental caries and gingival health in Finnish students. Caries Res. 1993;27(5):438-43.
Ventä I, Vehkalahti MM, Huumonen S, Suominen AL. Signs of disease occur in the majority of third molars in an adult population. Int J Oral Maxillofac Surg. 2017 Aug 16. pii: S0901-5027(17)31533-3.
von Wowern N, Nielsen HO. The fate of impacted lower third molars after the age of 20. A four-year clinical follow-up. Int J Oral Maxillofac Surg. 1989 Oct;18(5):277-80.
Wang D, He X, Wang Y, Li Z, Zhu Y, Sun C, Ye J, Jiang H, Cheng J. External root resorption of the second molar associated with mesially and horizontally impacted mandibular third molar: evidence from cone beam computed tomography. Clin Oral Investig. 2017 May;21(4):1335-1342.
Welch VA, Akl EA, Guyatt G, Pottie K, Eslava-Schmalbach J, Ansari MT, de Beer H, Briel M, Dans T, Dans I, Hultcrantz M, Jull J, Katikireddi SV, Meerpohl J, Morton R, Mosdol A, Petkovic J, Schünemann HJ, Sharaf RN, Singh JA, Stanev R, Tonia T, Tristan M, Vitols S, Watine J, Tugwell P. GRADE equity guidelines 1: considering health equity in GRADE guideline development: introduction and rationale. J Clin Epidemiol. 2017 Oct;90:59-67.
Wijs RW, Karssemakers LH, Becking AG. [Coronectomy. An alternative for complete removal of the third molar in the lower jaw]. Ned Tijdschr Tandheelkd. 2010 Jun;117(6):337-40.
Winter G.B. Impacted mandibular third molars. St Louis: American Medical Book Co.; 1926. p. 241–79.
Wu TH, Lin WC, Chen WK, Chang YC, Hwang JJ. Predicting cancer risks from dental computed tomography. J Dent Res. 2015 Jan;94(1):27-35.
Xavier RL, Vasconcelos BC, Caubi AF, Porto GG, Maurette MA. Passive drainage through the vestibular oblique incision in impacted inferior third molar surgery: a preliminary study. Acta Odontologica Latinoamericana 2008; Vol. 21, issue 1:57–63.
Yamalik K, Bozkaya S. The predictivity of mandibular third molar position as a risk indicator for pericoronitis. Clin Oral Investig. 2008 Mar;12(1):9-14.
Yamaoka M, Furusawa K, Ikeda M, Hasegawa T. Root resorption of mandibular second molar teeth associated with the presence of the third molars. Aust Dent J. 1999 Jun;44(2):112-6.
Zandi M, Shokri A, Heidari A, Masoud Peykar E. Objectivity and reliability of panoramic radiographic signs of intimate relation-ship between impacted mandibular third molar and inferior alveolar nerve. Oral Maxillofac Surg. 2015 Mar;19(1):43-8.
Zhou J, Hu B, Liu Y, Yang Z, Song J. The efficacy of intra-alveolar 0.2% chlorhexidine gel on alveolar osteitis: a meta-analysis. Oral Dis. 2016 Aug 1. doi: 10.1111/odi.12553
Richtlijn samenvatting
Richtlijn samenvatting
KPR Derde molaar
Verantwoording
+Deze klinische praktijkrichtlijn is bedoeld voor tandartsen en tandarts-specialisten. De richtlijn is ontwikkeld door een werkgroep van de Nederlandse Vereniging voor Mondziekten, Kaak- en Aangezichtschirurgie en beperkt aangepast door een Richtlijn Ontwikkel Commissie (ROC) van het Kennisinstituut Mondzorg (KIMO) onder voorzitterschap van dr. H. Ghaeminia, MKA-chirurg.
Inleiding
+Derde molaren breken in de regel door tussen het 18e en 26e levensjaar. De ruimte hiervoor kan beperkt zijn, wat geassocieerd is met kans op ziekte (bijv. gingivitis, schade aan de 2e molaar, cysten). Het beleid bij asymptomatische derde molaren was niet duidelijk. Ook waren er knelpunten ten aanzien van beeldvorming, chirurgische technieken en nazorg. Tot slot is benoemd welke informatie voor patiënten belangrijk is.
Aanbevelingen
+Voor deze richtlijn zijn uitgangsvragen opgesteld die zijn uitgewerkt met behulp van evidence en overwegingen door de experts in de richtlijnwerkgroep. Hieruit volgen samengevat de volgende aanbevelingen:
Diagnostiek en indicatie verwijdering asymptomatische derde molaar
Zie het stroomschema onderaan deze tekst.
Behandeling – Chirurgische technieken
- Triangulaire incisie geeft mogelijk minder alveolitis, pijnklachten en trismus dan envelop incisie, maar wel meer zwelling.
- Gebruik van een linguale retractor wordt ontraden.
- Gebruik voor het verwijderen van bot een chirurgische boor of piëzo.
- Spoel na het verwijderen van de derde molaar de wond en alveole ruim met fysiologisch zout.
- Overweeg na het verwijderen van een partieel geërupteerd element waar mogelijk de wond niet geheel primair te sluiten.
- Voer een coronectomie alléén uit bij patiënten met een sterk verhoogd risico op blijvende schade aan de nervus alveolaris inferior. Leg uit dat een 2e ingreep mogelijk noodzakelijk is.
Behandeling – overige aspecten
- Geef niet routinematig antibiotica. Bij aanwezigheid van risicofactoren voor postoperatieve complicaties of in geval van noodzaak tot antibioticaprofylaxe kan hiervan worden afgeweken.
- Overweeg het preoperatief laten spoelen met 0,12% of 0,2% chloorhexidine.
- Overweeg voorschrijven van 0,12% of 0,2% chloorhexidine om postoperatief gedurende 7 dagen 2dd te spoelen.
Informatie voor patiënten
Informeer patiënten bij wie een derde molaar wordt verwijderd over vaak optredende postoperatieve verschijnselen, zoals kortdurende nabezwaren: pijn, trismus en zwelling. Deze zijn maximaal op dag 2-3, daarna vindt afname plaats.
Informeer patiënten bij wie verwijdering van een onderste derde molaar wordt overwogen, over het risico op (al dan niet blijvende) schade aan de nervus alveolaris inferior (met als mogelijk gevolg een verminderde kwaliteit van leven, in situaties waarin röntgenologisch de volgende tekenen aanwezig zijn:
- Volledige overlap canalis mandibularis met de radices van derde molaar op de panoramische röntgenopname, en/of
- Tekenen van verhoogd risico zoals donkere wortelpunten, onderbreking van de radiopake lijn en deviatie van de canalis mandibularis op de panoramische röntgenopname.
Diagnostiek en indicatie verwijdering asymptomatische derde molaar
Patiënteninformatie
Patiënteninformatie
Verstandskiezen
1. Waarom deze informatie?
+Uw tandarts heeft voorgesteld om te onderzoeken of er een probleem is met de verstandskiezen. Misschien moeten ze worden verwijderd.
Deze informatie helpt u om samen met de tandarts of (mond)zorgverlener:
- de mogelijkheden te verkennen en
- een besluit te nemen.
2. Wat is het geval?
+Verstandskiezen zitten helemaal achterin de mond. Ze breken meestal door op een leeftijd tussen de 18 en 26 jaar. De ruimte achterin de mond kan beperkt zijn. Dan kunnen er soms problemen ontstaan. Dat gebeurt vooral bij verstandskiezen in de onderkaak. Deze problemen kunnen ontstaan aan de verstandskies, aan de kies die ervoor ligt of aan het tandvlees. Daarom is het soms verstandig om verstandskiezen te verwijderen voordat u klachten krijgt. Dat heet preventief verwijderen.
3. Wat gebeurt er?
+Stap 1: Onderzoek
- U bent bijna (of al) 17 jaar. De tandarts maakt een röntgenfoto in de mond. Op die foto is te zien:
- of er verstandskiezen in de onderkaak zijn;
- hoe deze in de kaak liggen;
- of ze naar verwachting normaal gaan doorbreken.
- Het is verstandig de verstandskiezen te verwijderen als de tandarts verwacht dat er problemen komen bij het doorbreken.
- U bent tussen de 18 en 30 jaar. De tandarts kijkt of de verstandskiezen zichtbaar zijn en hoe ze liggen. Het is verstandig de verstandskies in de onderkaak te verwijderen als deze gedeeltelijk, of in een verkeerde richting is doorgebroken. Er komt anders mogelijk schade aan de kies die ervoor ligt. Het is dan gebruikelijk ook de verstandskies in de bovenkaak te verwijderen. Zeker als deze niet goed is doorgebroken of als je deze niet goed zelf kunt schoonhouden.
- U bent ouder dan 30 jaar. Dan wordt preventieve verwijdering van de verstandskiezen niet aangeraden.
Stap 2: Vervolgonderzoek en verwijdering van de verstandskiezen
- Als de tandarts denkt dat dat preventieve verwijdering van de verstandskiezen bij u verstandig is, dan is vervolgonderzoek nodig.
- Sommige tandartsen doen zelf vervolgonderzoek en behandeling. Andere tandartsen verwijzen de patiënt door naar de kaakchirurg (ook wel: MKA-chirurg).
- Er wordt een nieuwe uitgebreidere 2D röntgenfoto gemaakt. Hiermee krijgt de tandarts een beter beeld van:
- de verstandskies;
- de naastgelegen kiezen;
- de gevoelszenuw van de onderlip en kin.
- Soms wordt nog een kleine 3D röntgenfoto (CT scan) gemaakt als de wortel te dicht bij de zenuw ligt.
- Hierna kan de tandarts of de kaakchirurg de verstandskiezen verwijderen.
- Antibiotica is normaal gesproken niet nodig.
- Soms krijgt u een recept mee voor chloorhexidine (een ontsmettend middel). Hiermee moet u gedurende een week tweemaal per dag uw mond spoelen.
- Er wordt een nieuwe uitgebreidere 2D röntgenfoto gemaakt. Hiermee krijgt de tandarts een beter beeld van:
Heel soms komt de zenuw bloot te liggen door de verwijdering van de verstandskies. Dit geeft na de behandeling een doof en prikkelend gevoel van de halve onderlip en/of kin. Meestal verdwijnt dit binnen een paar weken.
Als de wortel van de verstandskies te dicht tegen de zenuw aan ligt, dan kan de zenuw beschadigen bij verwijdering van de verstandskies. De kaakchirurg kiest er dan soms voor om alleen de kroon (bovenkant) van de verstandskies te verwijderen. De wortels blijven dan in de kaak achter. De kans op een blijvende gevoelsstoornis van de onderlip of kin is zeer klein.
4. Wat kunt u zelf doen?
+- Probeer de dag na de behandeling de mond goed te reinigen. En vergeet daarbij niet om de kies naast de wond mee te poetsen.
- U kunt pijn hebben als de verdoving is uitgewerkt. Daarom krijgt u een recept voor pijnstillers mee.
- Mogelijk wordt uw wang dik en krijgt u koorts. Koelen vermindert de zwelling.
- Ook kunt u moeite hebben met slikken en het openen van uw mond. Deze klachten gaan na twee tot drie dagen langzaam weer weg.
- Wordt de pijn of zwelling na drie dagen erger? Neem dan contact op met uw behandelaar.
5. Wat moet u niet doen?
+De wond kan de eerste 24 uur na de behandeling wat nabloeden. Dat houdt meestal vanzelf op. Spoelen van de mond vergroot de kans op nabloeden, dat moet u dus niet doen. Wel kunt u een schoon gaasje of zakdoek op de wond leggen als de wond nog bloedt. U bijt hier dan een half uur stevig op, zodat het goed op de wond drukt. Het bloeden stopt dan meestal.
6. Wanneer moet u contact opnemen met uw tandarts of kaakchirurg?
+- Als de wond blijft nabloeden (zie punt 5)
- Als de pijn of zwelling na 3 dagen erger wordt
De eerste 30 dagen na de behandeling neemt u hiervoor contact op met de tandarts of kaakchirurg die de verstandskies verwijderd heeft, ook als dat buiten kantooruren is. Na 30 dagen kunt u bij uw eigen tandarts terecht.
7. Wilt u naast deze informatie meer weten?
+Voor meer informatie kunt u altijd uw tandarts of kaakchirurg raadplegen.
Implementatie
Implementatie in de praktijk
Hoe kan de implementatie van de richtlijn bevorderd worden?
De ROC rekent het niet tot haar taak exact weer te geven hoe deze richtlijn geïmplementeerd zal moeten worden. Wel wil zij in deze beknopte bijdrage een aantal voorstellen ter bevordering van de implementatie doen. De volgende activiteit is al ondernomen of in gang gezet ter bevordering van de implementatie van de richtlijn:
- De betrokken wetenschappelijke verenigingen (NVMKA, NVvO, KNMT en NVvP) verspreiden de richtlijn onder al haar leden.
De richtlijnwerkgroep stelt de volgende activiteiten voor ter bevordering van de implementatie van de richtlijn:
- op eerstkomende wetenschappelijke jaarvergaderingen van de NVMKA, NVvO, KNMT en NVvP de bespreking van de richtlijn te agenderen om ‘startproblemen’ met de richtlijn te inventariseren en bijstelling mogelijk te maken;
- op lokaal niveau – waar relevant – delen van de richtlijn om te zetten in protocollen;
- publicatie van de belangrijkste aanbevelingen in het Nederlands tijdschrift voor tandheelkunde;
- ontwikkeling van pre- en postoperatieve patiëntenfolder die via website aan alle behandelaars beschikbaar wordt gesteld, in het kader van uniforme informatie aan de patiënt
- Verdere ontwikkeling van de keuzehulp (zie bijlage 10).